
Eläinkokeettomilla tutkimusmenetelmillä voidaan tuottaa tietoa lääkkeiden, kemikaalien, elintarvikkeiden ja lääkinnällisten laitteiden turvallisuudesta sekä lääkkeiden vaikutusmekanismeista. Viranomaiset suhtautuvat myönteisesti eläinkokeettomien menetelmien käyttöönottoon.
Kemikaalien – olkoonpa ne lääkkeitä, biosidejä tai teollisuuskemikaaleja – turvallisuutta ihmiselle arvioidaan pääosin eläinkokeiden avulla. Turvallisuuden osoittaminen edellyttää laajoja eläimillä tehtäviä toksisuustutkimuksia, joihin kuuluvat tapauskohtaisesti valittavat yleinen toksisuus, genotoksisuus, karsinogeenisuus sekä lisääntymis- ja kehitystoksisuus. Lääkkeillä selvitetään lisäksi niiden farmakologiaa sekä kinetiikkaa (ADME), mikä myös edellyttää eläinten käyttöä. Myös ympäristövaikutusten turvallisuusarvioinnissa käytetään eläinkokeita. Poikkeuksena on kosmetiikkalaki, joka kieltää eläinkokeiden käytön. Turvallisuus tulee arvioida eläinkokeettomasti.
Erityisesti Euroopassa ja Yhdysvalloissa halutaan korvata eläinkokeet eläinkokeettomilla testeillä ja lähestymistavoilla. Eläinkokeettoman riskinarvioinnin periaate on esitetty strategiadokumentissa, jonka mukaan riskinarviointi pohjautuu solupohjaisten mallien käyttöön yhdistettynä tietokonepohjaisiin ohjelmiin. Euroopan komission mukaan perinteisiin eläinkokeisiin pohjautuva riskinarviointi ei ole riittävän ennustava eikä tehokas. OECD ja Euroopan kemikaalivirasto (ECHA) ovat julkaisseet konkreettisia ohjeita, miten riskinarviointia voidaan tehdä eläinkokeettomasti.
Lääkekehityksen huonon onnistumistodennäköisyyden (n. 13,8 %) on osoitettu johtuvan ihmisissä esiin tulleista haittatapahtumista, mutta ennen kaikkea tehottomuudesta. Tähän tarpeeseen uskotaan löytyvän ratkaisu kattavien in vitro -testausten ja niihin yhdistettävien tietokonemallien avulla.
Perinteisesti solumalleja käytetään eläinkokeiden ohessa perus- ja soveltavassa biolääketieteellisessä tutkimuksessa sekä tutkittaessa yhdisteiden vaikutusmekanismeja ja biologisia prosesseja.
Lääketutkimus on osoittanut, että jyrsijätautimallit mallintavat puutteellisesti ihmisen tauteja ja niiden molekulaarisia mekanismeja. Myös tästä syystä tarvitaan eläinkokeettomia kudos- ja tautimalleja. Yksi esimerkki lupaavasta tautimallista on Parkinsonin tautimalli. Joidenkin kemikaalien, kuten tiettyjen pestisidien, on todettu liittyvän Parkinsonin taudin syntyyn. Mekanismipohjaiset testit auttavat havaitsemaan kemikaalien haitalliset vaikutukset kriittisiin Parkinsonin tautiin liittyviin prosesseihin. Toinen esimerkki on yksilöllistetyt lääkehoidot. Syöpähoidoissa voidaan käyttää potilaan syöpäsoluviljelmiä valittaessa parasta lääkehoitoa.
Eläinkokeettomien menetelmien hyväksyntä viranomaisdokumentaation osana
Kemikaalien, biosidien, kasvinsuojeluaineiden, lääkkeiden, elintarvikkeiden valmistusaineiden, lisäaineiden, makuaineiden ja entsyymien sekä lääkinnällisten laitteiden markkinoille saattaminen edellyttää niiden turvallisuuden tutkimista eläinkokein.
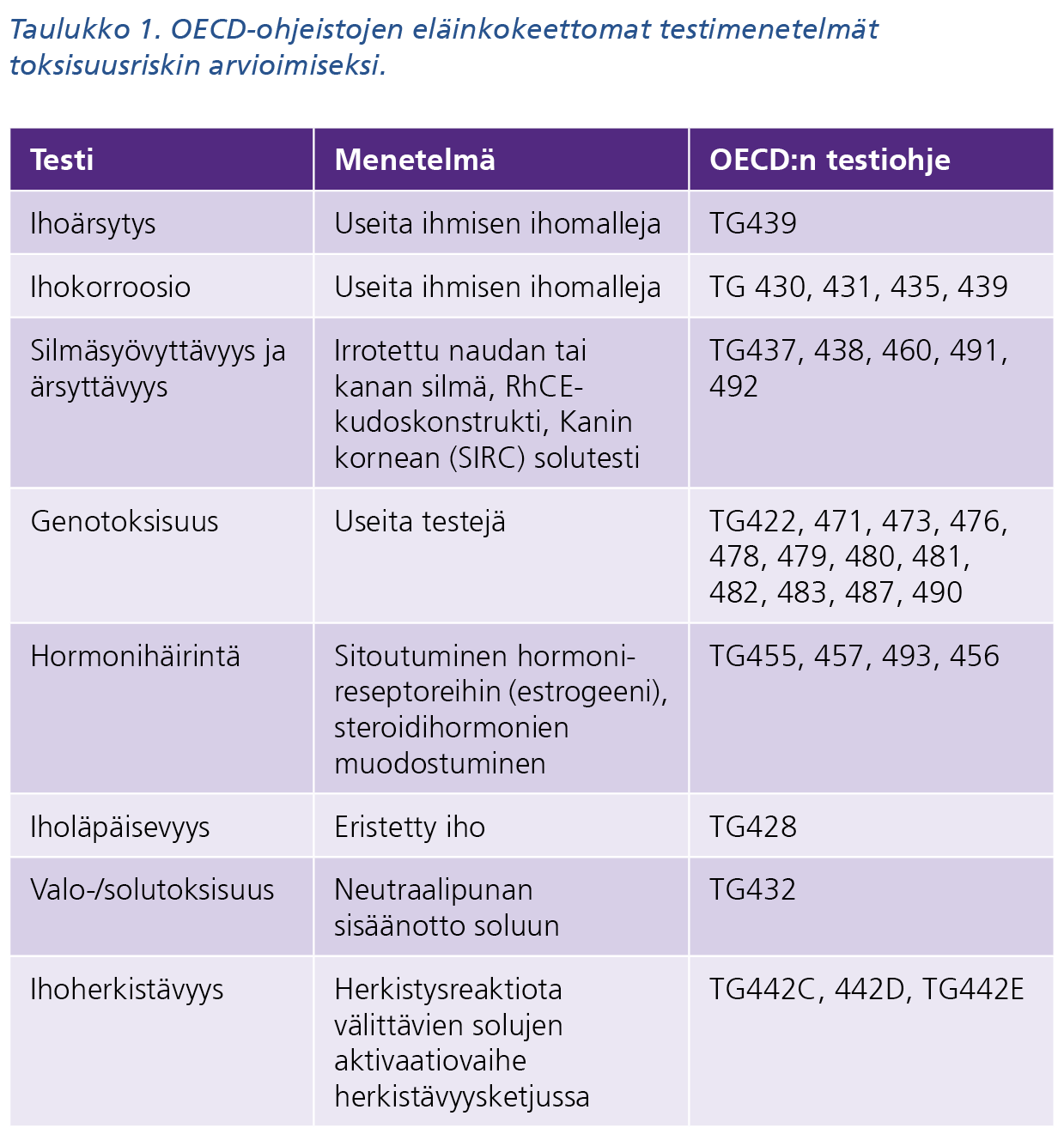
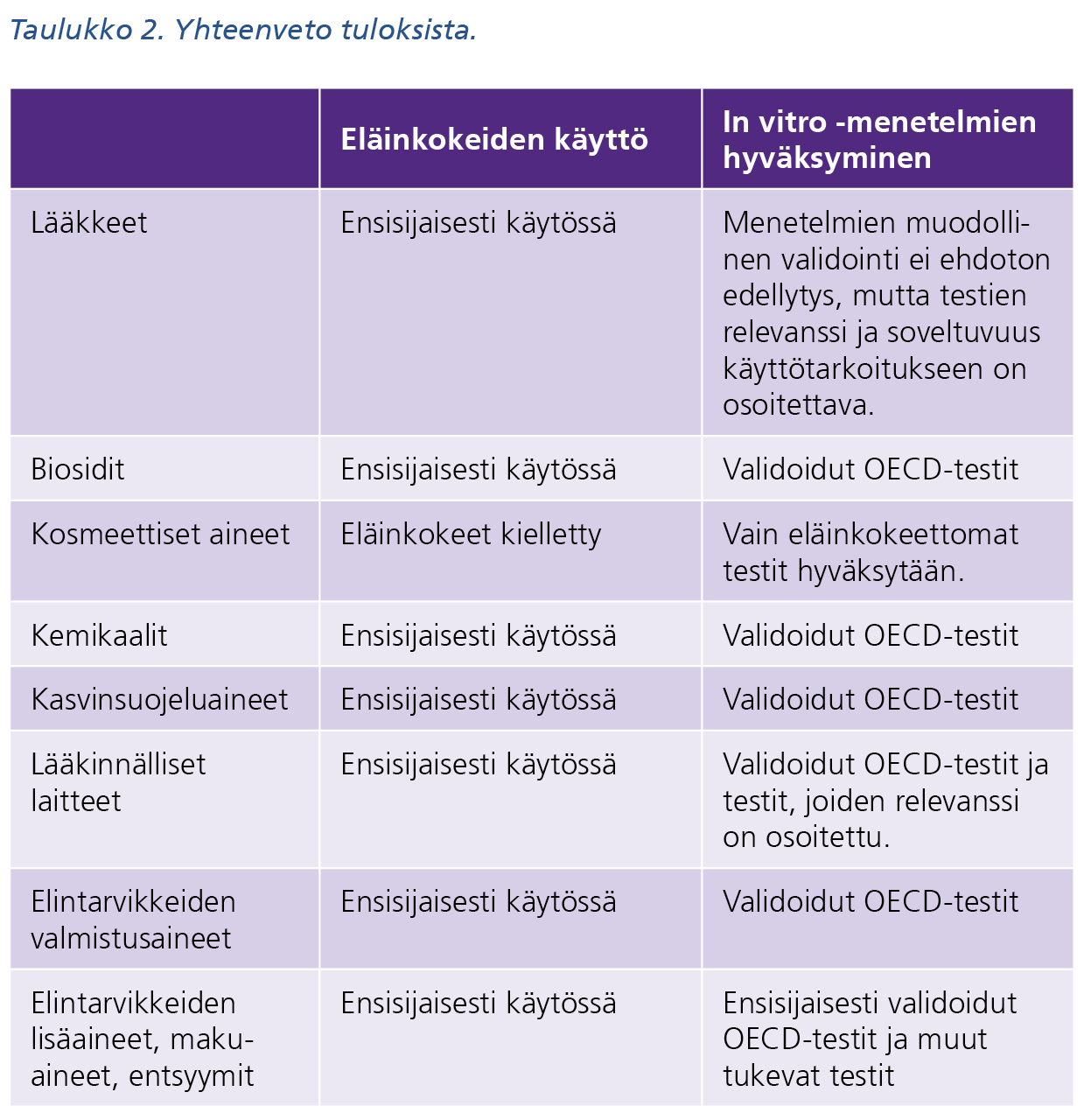
Maa- ja metsätalousministeriön tieteellisiin tai opetustarkoituksiin käytettävien eläinten suojelun neuvottelukunta (TOKES) kartoitti kyselytutkimuksena Suomen viranomaisten kantaa eläinkokeettomien menetelmien käytön hyväksymiseen yleisesti sekä OECD:n (taulukko 1) hyväksymiin in vitro -menetelmiin (taulukko 2).
Taulukon 1 tekstivastine saavutettavassa muodossa (pdf)
Taulukon 2 tekstivastine saavutettavassa muodossa (pdf)
Toukokuussa 2018 toteutettu kysely lähetettiin seuraaville viranomaisille: Tukes, Fimea, Evira, Valvira sekä ilmoitetuille laitoksille VTT ja SGS, joiden toimivaltaan ne kuuluvat.
Turvallisuuden arviointia ohjaa pitkälti lainsäädäntö ja sen pohjalta laaditut ohjeistot. Eläinkokeettomien menetelmien osalta kyselyn tulos (taulukko 2) heijastaa tukeutumista validoituihin OECD:n hyväksymiin in vitro -menetelmiin käytettäessä muita kuin eläinkokeita tietovaatimusten täyttämisessä. Yhteisölainsäädäntöön sekä EU:n ohjeistoihin on laajasti suosituksia 3R-periaatteiden soveltamisesta aina kun mahdollista. Kansalliset viranomaiset pyrkivät noudattamaan Euroopan keskusvirastojen ECHAn, Euroopan lääkeviraston (EMA) sekä Euroopan elintarviketurvallisuusviraston (EFSA) vaatimuksia ja suosituksia. Esimerkiksi lääkkeiden turvallisuudesta vastaavilla viranomaisilla on mahdollisuus hyväksyä eläinkokeettomia menetelmiä, jos niiden relevanssi ja soveltuvuus käyttötarkoitukseen on osoitettu.
Tarvitaanko eläinkokeita?
Viranomaiset ovat olleet aktiivisia pyrkiessään vähentämään eläinten käyttöä regulatoristen vaatimusten mukaisissa tutkimuksissa. Viranomaiset suosittelevat eläinkokeettomien menetelmien käyttöä aina, kun se on mahdollista tai soveltuva in vitro -testi on hyväksytty.
Tällä hetkellä vain pieni osa vaadituista tutkimuksista voidaan tehdä eläinkokeettomasti. Niitä on hyväksytty pääasiassa paikallisvaikutusten ja syöpävaarallisuuden tutkimiseen (taulukko 1). Eläinkokeita tullaan vielä tarvitsemaan laajasti, mutta korvaavien menetelmien kehittäminen on kiivasta ja niiltä odotetaan paljon. Ihmisen soluihin ja kudoksiin perustuvat in vitro- ja ex vivo -mallit, kuten solu- ja kudosviljelmät sekä organoidit, voivat tarjota ennustavamman mallin lääkkeiden toimivuuden ja turvallisuuden tutkimiseen kuin perinteiset eläinkokeet tai eläinsoluihin perustuvat mallit. Solumallit ovat potentiaalinen työväline myös potilaskohtaisen terapian valintaan.
Kirjallisuutta
ECHA. How to use new or revised in vitro test methods to address skin sensitization. ENV/JM/MONO(2017)15. https://echa.europa.eu
Euroopan neuvosto. Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use.
Euroopan neuvosto. REACH regulation. EC No 1907/2006 of the European Parliament and the Council on Chemicals and their safe use. Registration, evaluation, authorisation and restriction of chemicals. Official Journal of the European Union 30.12.2006.
Euroopan neuvosto. Regulation EU No 528/2012 of the European Parliament and the Council concerning the making available on the market and use of biocidal products.
Euroopan neuvosto. Directive 2003/15/EC of the European Parliament and of the Council of 27 February 2003 amending Council Directive 76/768/EEC on the approximation of the laws of the Member States relating to cosmetic products.
Heinonen T, Tähti H. Eläinkokeettomat menetelmät tutkimuksessa ja testauksessa. Sic! 2014; 4(1): 42–45.
Toxicity testing in the twenty-first century: A vision and a strategy. Washington DC, USA. National Research Council. National Academic Press 2007.
OECD. Guidance document for the use of adverse outcome pathways in developing integrated approaches to testing and assessment (IATA). Series on testing and assessment no 260. ENV/JM/MONO(2016)67.
OECD. Guidance document on developing and assessing adverse outcome pathways. Environment, health and safety publications, series on testing and assessment no 184. ENV/JM/MONO(2013)6.
OECD. Guidance document no 263 on integrated approaches to testing and assessment (IATA) for serious eye damage and eye irritation. Series on testing and assessment no 263.
OECD Guidelines for the testing of chemicals, section 4, health effects. OECD. www.oecd.org
OECD. New Guidance document on an integrated approach on testing and assessment (IATA) for skins corrosion and irritation. Series on testing and assessment no 203. ENV/JM/MONO(2014)19.
Pamies D, ym. A human brain microphysiological system derived from induced pluripotent stem cells to study neurological diseases and toxicity. ALTEX. 2017; 34(3): 362–76.
Smits L M, ym. Modeling Parkinson’s disease in midbrain-like organoids npj Parkinson's disease. Julkaistu 5.4.2019. www.nature.com
Terron A, ym. An adverse outcome pathway for parkinsonian motor deficits associated with mitochondrial complex I inhibition. Arch Toxicol 2018; 92(1): 41–82.
TOKES. https://mmm.fi/tokes
Votanopoulos K I, ym. Appendiceal cancer patient-specific tumor organoid model for predicting chemotherapy efficacy prior to initiation of treatment: A feasibility study. Ann. Surg Oncol 2018; 26(1): 139 –47.
Wong C H, ym. Estimation of clinical trial success rates and related parameters. Biostatistics 2019; 20(2): 273–86.


