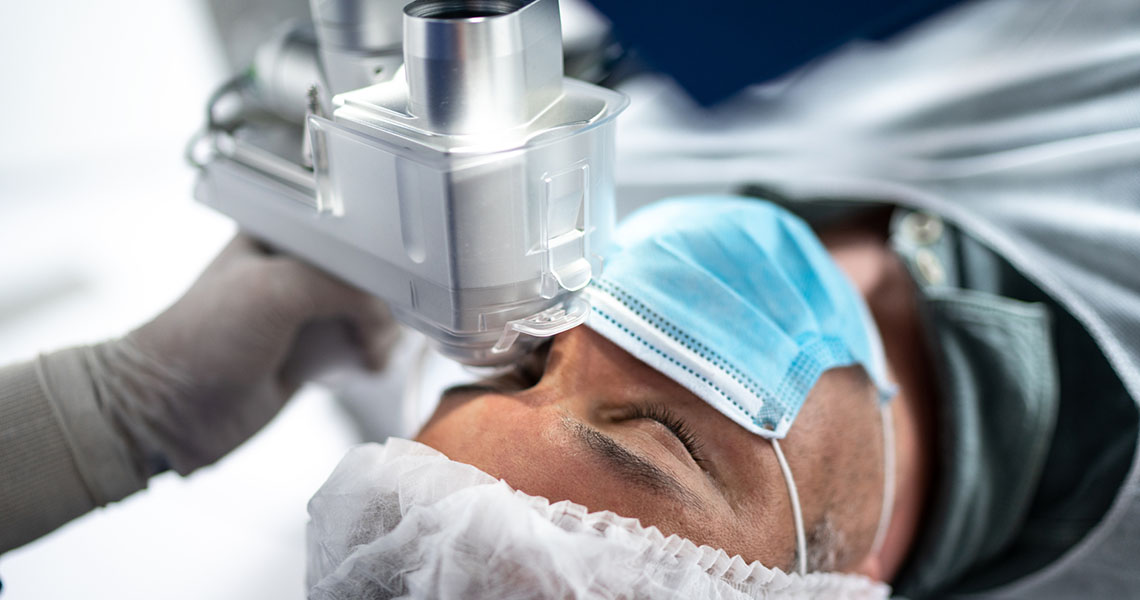
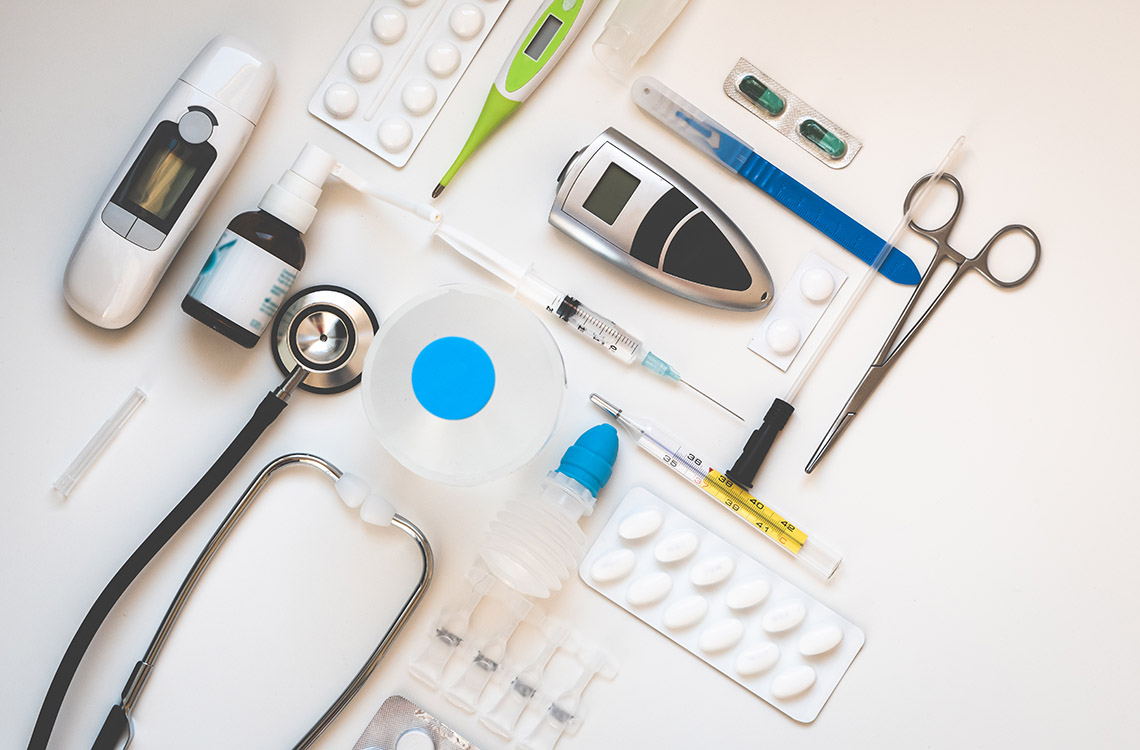
Som medicintekniska produkter räknas ett brett spektrum av utrustning, hjälpmedel och programvara, vars syfte är att diagnostisera, förebygga och behandla sjukdomar och skador. Inspektör Minna Kymäläinen handlägger och övervakar kliniska prövningar i anknytning till medicintekniska produkter vid Fimea.
När man hör ordet medicinteknisk produkt tänker man ofta på en elektronisk apparat som används inom hälso- och sjukvården, t.ex. en röntgenapparat eller respirator. Termen avser dock all slags utrustning, hjälpmedel och programvara, vars syfte är att diagnostisera, förebygga och behandla sjukdomar och skador.
– Blocktrycksmätare som används hemma är medicintekniska produkter, detsamma gäller även graviditetstest, glasögon, plåster och till och med kylgel för muskelvärk, förklarar Minna Kymäläinen, inspektör vid Fimea.
Produktens avsedda användning och verkningssätt avgör om den är en medicinteknisk produkt eller en annan typ av produkt, t.ex. ett läkemedel eller ett kosmetiskt preparat.
En viktig skillnad mellan läkemedel och medicintekniska produkter är att läkemedel har en farmakologisk, immunologisk eller metabolisk verkan i människokroppen, vilket medicintekniska produkter inte har. Kosmetik och hygienprodukter å andra sidan lindrar och behandlar ingenting.
– Ibland är det väldigt svårt att dra gränsen. På marknaden finns t.ex. en hormonspiral, som är ett läkemedel, men också en kopparspiral, som är en medicinteknisk produkt, säger Kymäläinen.
För att en medicinteknisk produkt ska kunna släppas ut på marknaden måste tillverkaren visa att produkten är säker och effektiv i den miljö där den är avsedd att användas. En sådan produkt är försedd med CE-märkning.
Över en halv miljon medicintekniska produkter
Fimea utövar tillsyn över medicintekniska produkter och aktörer inom branschen i Finland. Tillsynen omfattar bland annat marknadsföringen av medicintekniska produkter, rapporter om tillbud och kliniska prövningar, dvs. prövningar på människa.
Vid Fimea arbetar 18 personer med övervakning av medicintekniska produkter. Minna Kymäläinen och hennes fyra kollegor arbetar specifikt med handläggning och övervakning av kliniska prövningar av medicintekniska produkter.
– Det är mycket arbete, eftersom det finns över en halv miljon medicintekniska produkter på marknaden över hela Europa. I fjol fick vi in över 4 700 anmälningar om tillbud och drygt 50 prövninganmälningar, berättar hon.
Om det kommer in många anmälningar om tillbud som rör en viss produkt utreder man vid Fimea om felet beror på produkten, dess användning, utbildningen om produkten eller produktens anvisningar.
Tillsynen genomförs till exempel genom att man gör inspektioner vid aktörernas enheter. Om det kommer in många anmälningar om tillbud som rör en viss produkt utreder man vid Fimea om felet beror på produkten, dess användning, utbildningen om produkten eller produktens anvisningar.
– Meddelanden om olika problem kommer även från konkurrenter, sjukhus och konsumenter. Vi följer också vad som händer ute i världen via branschpressen och via tillsynsmyndigheterna i andra länder.
Kymäläinen behandlar ansökningar om kliniska prövningar, begär vid behov förtydliganden av aktörerna och fattar beslut om tillstånd. Dessutom övervakar hon om prövningarna genomförs i enlighet med ansökningarna och handleder forskarna i tillämpningen av lagstiftningen.
– När en ny prövning läggs framför mig blir jag verkligen entusiastisk! Vi har ett oräkneliga bra forskningsgrupper, lysande akademiska forskare och små startup-företag med enorm kompetens. Jag ser från första parkett allt det intressanta som sker inom branschen, säger Kymäläinen med ett leende.
Den nya förordningen skärpte kraven
Tidigare ansvarade Valvira för övervakningen av medicintekniska produkter i Finland, men sedan början av 2021 har Fimea ansvaret. Även lagstiftningen om medicintekniska produkter ändrades när den nya EU-förordningen trädde i kraft under våren 2021.
Enligt Kymäläinen ändrade den nya förordningen i hög grad kraven på kliniska prövningar av medicintekniska produkter.
– Forskarna måste på förhand informera mycket tydligare om vilken typ av forskning de utför. Dessutom blev handläggningstiderna kortare för både myndigheter och anmälare.
I förordningen klassificeras medicintekniska produkter i riskklasserna I, IIa, IIb och III enligt produktens avsedda ändamål och de risker som är förknippade med användningen av produkten. Ju högre riskklass, desto mer bevis på produktens prestanda och säkerhet krävs.
– Till klass III hör till exempel implantat, såsom hjärtklaffar och ledproteser. Dessa måste alltid genomgå en klinisk prövning innan produkten får släppas ut på marknaden. För andra medicintekniska produkter är prövningarna frivilliga, förklarar Kymäläinen.
Tidigare meddelade myndigheterna endast aktören när prövningsanmälan hade behandlats, men nu utfärdas ett överklagbart beslut. I förordningen föreskrivs dessutom en skyldighet för myndigheterna att utföra inspektioner på prövningsplatsen.

Minna Kymäläinen upplever att hon i sin roll på Fimea har första parkett till den intressanta forskning som bedrivs i Finland inom området för medicintekniska produkter. – När en ny prövning läggs framför mig blir jag verkligen entusiastisk! säger hon.
Förordningen gör det också möjligt att i framtiden behandla ansökningar om tillstånd för europeiska multicenterprövningar genom ett samordnat förfarande i en enda medlemsstat. Enligt Kymäläinen skulle detta minska både de sökandes och myndigheternas arbetsbörda.
Inte bara övervak
En stor del av Minna Kymäläinens arbetstid går åt till rådgivning och handledning. Aktörerna har många frågor om den nya förordningen.
– Samma forskare kan ringa tre eller fyra gånger och fråga vad som menas med kraven i förordningen, berättar Kymäläinen.
Enligt förordningen är syftet med de kliniska prövningarna att säkerställa produktens prestanda eller säkerhet, eller båda, i den miljö där produkten är avsedd att användas. Prövningarna ska planeras och genomföras på ett sätt som garanterar deltagarnas rättigheter och välbefinnande. De kliniska data som erhålls måste vara vetenskapligt giltiga och tillförlitliga.
Kymäläinen upplever sig inte bara vara en övervakare av prövningar, utan också en möjliggörare.
”Visst tjatar jag också ibland om kraven i förordningen. Man ska komma ihåg att det inte handlar om att tjänstemännen vill retas, utan om att de har en skyldighet.”
– Visst tjatar jag ibland om kraven i förordningen. Man ska komma ihåg att det inte handlar om att tjänstemännen vill retas, utan om att de har en skyldighet, påpekar hon.
Kymäläinen har trivts bra vid Fimea. Hon upplever att det är lätt att arbeta i arbetsgemenskapen.
– Jag har turen att jobba med människor som tänker väldigt likadant. Det finns alltid personer i närheten som jag kan be om hjälp av, säger hon.
Personen bakom rollen
Vem?
Minna Kymäläinen
Vad arbetar du med vid Fimea?
Jag arbetar som inspektör i övervakningen av medicintekniska produkter, där jag arbetar med handläggning och övervakning av kliniska prövningar. Till mina uppgifter hör dessutom behandling av tillstånd för organtransplantationer och rådgivning i anslutning till detta.
Vilken är din utbildningsbakgrund?
Jag är specialsjukskötare till utbildningen. Jag utexaminerades som sjukskötare 1988 och specialiserade mig på anestesi- och intensivvård 1992.
Hur såg din karriär ut innan du började vid Fimea?
Efter min examen arbetade jag som anestesisjukskötare vid Södra Karelens centralsjukhus och vid HUS vid Mejlans sjukhus. Därefter övergick jag till forskning och produktutveckling inom industrin. Jag arbetade på GE Healthcare, där jag bland annat medverkade i forskning där man utförde mätning av sömndjup.
Varför började du arbeta vid Fimea?
Jag tänkte att jag ännu kunde prova ett tredje perspektiv på medicintekniska produkter. Jag började vid Läkemedelsverket 2009, alltså samma år som Läkemedelsverket blev Fimea och Valvira. De medicintekniska produkterna hamnade på Valviras ansvar, dit jag också flyttade. Jag återvände till Fimea i början av 2021 när tillsynen över medicintekniska produkter överfördes till Fimea.
Vad var överraskande vid Fimea?
Människornas breda sakkunskap har varit överraskande. Oavsett om det är fråga om läkemedel, narkotika eller vävnadspreparat finns det enormt mycket kunnande och know-how här.
Höjdpunkten i din karriär vid Fimea?
Jag kommer att tänka på två höjdpunkter. Den ena var färdigställandet av föreskriften ”Kliniska prövningar med medicintekniska produkter” på våren i fjol, den andra publicerandet av tioårsplanen för organtransplantationsverksamheten i slutet av förra året. I båda fallen låg mycket arbete bakom.
Bästa sättet att varva ner från arbetet på fritiden?
Jag älskar kulturevenemang och att läsa böcker. Jag ger alltid teatertips till hela gänget! Jag är också en ivrig bänkidrottare och deltar som volontär vid olika idrottstävlingar. Jag deltog till exempel i första hjälpen-teamen vid VM i ishockey våren 2022.
Tillsyn över medicintekniska produkter och kliniska prövningar
- Fimea utövar tillsyn över medicintekniska produkters överensstämmelse med kraven och över aktörerna inom branschen i Finland.
- Dessutom övervakar Fimea bland annat marknadsföringen av medicintekniska produkter och behandlar anmälningar om tillbud i anslutning till dem.
- Tillsynen sker i samarbete med andra EU-myndigheter.
- Syftet med de kliniska prövningarna av medicintekniska produkter är att säkerställa produktens prestanda eller säkerhet, eller båda, i den miljö där produkten är avsedd att användas.
- I prövningarna ska deltagarnas rättigheter och välbefinnande garanteras.
- De kliniska data som erhålls genom prövningarna måste vara vetenskapligt giltiga och tillförlitliga.