Lagstiftningen har preciserats och förtydligats, vilket underlättar arbetet för myndigheter och aktörer i gränsdragningssituationer. För konsumenten och yrkesmässiga användare är det viktigaste att använda produkten enligt anvisningarna för det av tillverkaren angivna ändamålet.
Tillämpningsområdet för, definitionerna och klassificeringarna i förordningen om medicintekniska produkter som förnyades våren 2021 har förtydligats. Samtidigt preciserades tillämpandet av förordningen i gränsdragningssituationer och i fråga om kombinationsprodukter.
Gränsdragning krävs till exempel i gränsfallsfrågor som innefattar läkemedel, vävnadsprodukter av mänskligt ursprung, levande mikroorganismer, kosmetika eller biocidprodukter och andra produkter.
De tidigare bestämmelserna lämnade tolkningsutrymme i gränsdragningssituationer, vilket har minskat med lagstiftningsreformen. Exempelvis ingår inte längre levande transplantat, vävnader eller celler i tillämpningsområdet för den nuvarande förordningen.
Gränsdragningen påverkar den tillämpliga lagstiftningen
Ur den tillämpliga lagstiftningens perspektiv är artikeln antingen ett läkemedel eller en medicinteknisk produkt.
Ingen sjukdom eller produktgrupp i sig definierar en produkt som en medicinteknisk produkt. Den avsedda användningen och verkningsmekanismen som tillverkaren har fastställt är centrala faktorer vid bedömning av om en produkt är en medicinteknisk produkt, ett läkemedel eller en kosmetisk produkt. Samma besvär kan behandlas med till exempel läkemedel eller en medicinteknisk produkt. Ur den tillämpliga lagstiftningens perspektiv är artikeln antingen ett läkemedel eller en medicinteknisk produkt.
Med kombinationsprodukter förknippas alltid krav på att reglera båda delarna. I fråga om till exempel kombinationsprodukter omfattande såväl medicintekniska produkter som läkemedel, såsom förfyllda sprutor, måste lagstiftningen om både läkemedel och medicintekniska produkter beaktas.
I förordningen om medicintekniska produkter (artikel 117) beskrivs vilka krav som gäller för den medicintekniska delen i en kombinationsprodukt som klassificeras som läkemedel. Dessutom beskrivs i förordningen särskilda ytterligare förfaranden som tillämpas på produkter som innehåller en läkemedelssubstans. Europeiska läkemedelsmyndigheten (EMA) har dessutom publicerat ytterligare anvisningar om kombinationsprodukter på sin webbplats.
Om produktklassificering och tillämpning av klassificeringsreglerna finns en nyligen publicerad anvisning från samordningsgruppen för medicintekniska produkter (MDCG 2021-24). Den finns tillgänglig på Europeiska kommissionens webbplats.
För vilket ändamål och varför?
För konsumenten eller den yrkesmässiga användaren är det viktigaste att förstå för vilket ändamål och på vilket sätt den valda produkten ska användas.
Klassificeringen och gränsdragningen är en verksamhet mellan myndigheten och tillverkaren. För konsumenten eller den yrkesmässiga användaren är det viktigaste att förstå för vilket ändamål och på vilket sätt den valda produkten ska användas, oavsett om det är fråga om en produkt, ett läkemedel eller en kombination av dessa.
En medicinteknisk produkt är en produkt som tillverkaren har tillverkat för att användas för medicinskt syfte och riskklassificerat. Tillverkaren förser dessa produkter med en CE-märkning för medicintekniska produkter för att på så sätt bekräfta att produkten uppfyller kraven enligt lagstiftningen. På vissa produkter anges, liksom tidigare, även numret på det anmälda organet när ett bedömningsorgan har deltagit i bedömningen av överensstämmelsen.
Den förnyade lagstiftningen kräver utöver CE-märkning också att användaren informeras om att det är fråga om en medicinteknisk produkt. Detta får anges i bruksanvisningen och förpackningspåskrifterna i textform eller med MD-symbolen (bild 1). Symbolen kan göra det lättare att identifiera en medicinteknisk produkt och skilja den från andra produkter till exempel på apotek och i webbhandeln.
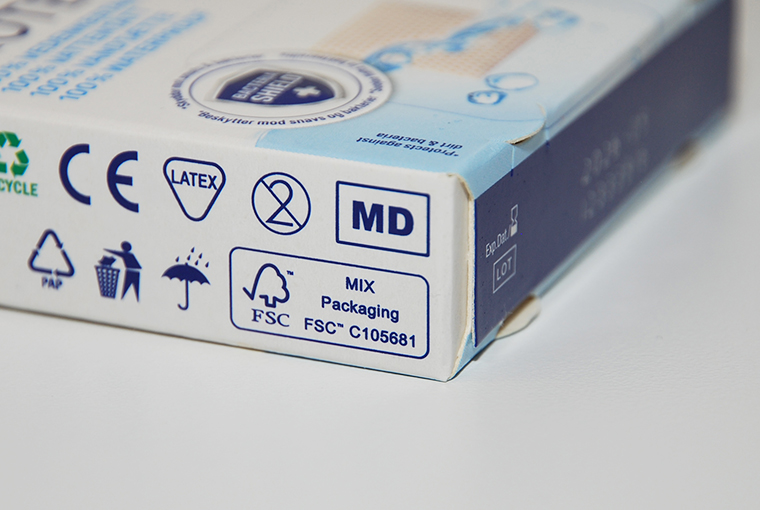
Bild 1. MD-symbolen på den meditekniska produktens förpackning. © Fimea
Myndighetssamarbete nationellt och på EU-nivån
Myndigheterna bedriver ett nära samarbete både nationellt och på EU-nivån i fråga om produktklassificering, gränsdragningsprodukter och kombinationsprodukter. Dessutom ger myndigheterna tillverkare, importörer, distributörer och professionella användare vägledning inom området.
Kraven i den nya förordningen om medicintekniska produkter är striktare än hittills, men också tydligare än tidigare. Beslut om den rättsliga statusen för och produktklassificeringen av för medicintekniska produkter fattas av kommissionen och nationella myndigheter i enlighet med sin arbetsfördelning. Ändå finns det fortsatt behov av gemensam tolkning och dialog där alla aktörer deltar.
Vad är en medicinteknisk produkt?
En produkt för vilken lagstiftningen om medicintekniska produkter anger ett medicinskt syfte.
En produkt som används på människor (inte på djur).
Den huvudsakliga, avsedda verkan uppnås inte med hjälp av farmakologiska, immunologiska eller metaboliska medel, men funktionen kan understödjas med sådana medel.
En produkt som är försedd med CE-märkning för medicintekniska produkter.
Vad är ett läkemedel?
Med ett läkemedel avses ett preparat eller ämne vars ändamål är att vid invärtes eller utvärtes bruk bota, lindra eller förebygga sjukdomar eller sjukdomssymptom hos människor eller djur.
Som läkemedel betraktas också ett sådant ämne eller en sådan kombination av ämnen för invärtes eller utvärtes bruk som kan användas för att genom farmakologisk, immunologisk eller metabolisk verkan återställa, korrigera eller modifiera fysiologiska funktioner eller utröna hälsotillståndet eller sjukdomsorsaker.
Läkemedel är inte försedda med CE-märkning.
Lagstiftning och mer information
Lag om medicintekniska produkter 719/2021 (Finlex.fi)