Koronarokotteiden yleisimmät haittavaikutukset ovat tyypillisiä rokotehaittoja eli pistospaikan reaktioita ja lieviä yleisoireita. Terveydenhuollon ammattilaisia ja kuluttajia pyydetään ilmoittamaan erityisesti odottamattomista ja vakavista koronarokotteisiin liittyvistä haittavaikutusepäilyistä. Näihin perustuen kansallisella ja kansainvälisellä tasolla tehdään rokoteturvallisuuden parantamiseen tähtäävää turvallisuussignaalien etsintää ja arviointia.
Suomessa ensimmäisenä käyttöön otetut koronarokotteet ovat Pfizer-BioNTechin Comirnaty ja Modernan COVID-19 Vaccine Moderna. Ne ovat uudentyyppisiä mRNA-rokotteita. Elimistön immuunijärjestelmä tuottaa rokotteiden sisältämän lähetti-RNA:n vaikutuksesta vasta-aineita, jotka antavat suojan SARS-CoV-2-viruksen aiheuttamaa COVID-19-infektiota vastaan. Rokotteet eivät sisällä itse virusta, eivätkä siksi voi aiheuttaa infektiota.
Kolmantena Suomessa käyttöön tuleva rokote on AstraZenecan COVID-19 Vaccine Astra Zeneca. Tämä rokote on tyypiltään virusvektorirokote. Se sisältää vaaratonta adenovirusta ja koodaa SARS-CoV-2-viruksen pintaproteiinia. Rokotetun henkilön immuunijärjestelmä alkaa tuottaa tätä piikkiproteiinia, jota vastaan elimistö kehittää immuunivasteen. Tämäkään rokote ei sisällä COVID-19-infektiota aiheuttavaa koronavirusta.
Comirnatya voidaan käyttää yli 16-vuotiaiden ja muita rokotteita yli 18-vuotiaiden henkilöiden rokottamiseen. Kaikkia rokotteita annetaan kaksi annosta. Comirnatylla antovälin tulee olla vähintään kolme viikkoa, COVID-19 Vaccine Modernalla neljä viikkoa ja COVID-19 Vaccine Astra Zenecalla 1–3 kuukautta.
Comirnatyn suojaava vaikutus saavutetaan viikko toisen rokoteannoksen jälkeen, COVID-19 Vaccine Modernalla kaksi viikkoa ja COVID-19 Vaccine Astra Zenecalla 15 vuorokautta toisesta rokoteannoksesta. Mikään rokotteista ei välttämättä anna kaikille rokotetuille täyttä suojaa COVID-19 infektiota vastaan, eikä toistaiseksi ole tiedossa, miten kauan rokotteiden suojaava vaikutus kestää.
Koronarokotteita tulee antaa harkiten sellaisille ihmisille, jotka ovat aiemmin saaneet vakavan allergisen reaktion tai hengitysvaikeuksia muista rokotteista, jotka ovat vakavasti sairaita, korkeakuumeisia tai joiden immuunijärjestelmä on heikentynyt esimerkiksi käytetyn lääkityksen johdosta.
Koronarokotteiden haittavaikutukset
Kaikkiin rokotteisiin liittyy haittavaikutuksia, joista osa on havaittu ennen myyntiluvan myöntämistä tehdyissä laajoissa kliinisissä lääketutkimuksissa, mutta osa havaitaan vasta valmisteen tultua markkinoilla. Yleisimpiä pistettävien rokotteiden haittavaikutuksia ovat pistospaikan reaktiot, kuten kipu, turvotus, punoitus, kuumotus, kutina ja kovettuma.
Rokotteiden avulla pyritään saamaan ihmisen keho tuottamaan vasta-aineita virusta tai bakteeria vastaan. Immuunijärjestelmän stimulointiin liittyviä tyypillisiä rokotehaittoja ovat kuume, väsymys, lihas- ja nivelkivut sekä päänsärky.
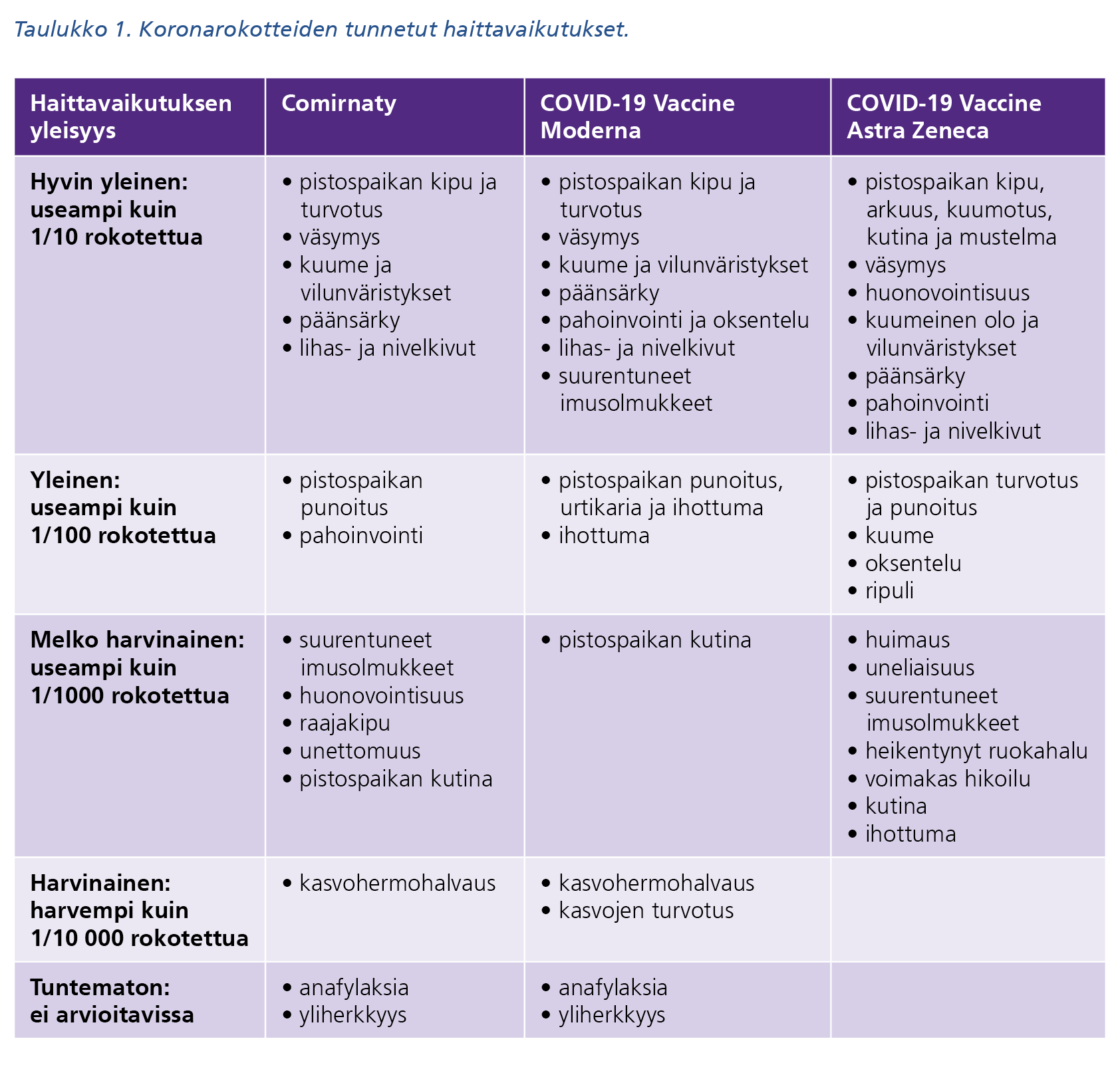
Yleisimmät Comirnatyn, COVID-19 Vaccine Modernan ja COVID-19 Vaccine Astra Zenecan tuotetietoissa listatut haittavaikutukset ovat tyypillisiä rokotehaittoja eli pistospaikan reaktioita ja lieviä yleisoireita (taulukko 1). Comirnatyn antoon liittyen on raportoitu myös vakavia anafylaktisia reaktioita, joiden yleisyydestä ei ole vielä tarkkaa tietoa.
Taulukon 1 sisältö saavutettavassa pdf-tiedostossa.
Molempien mRNA-rokotteiden harvinainen haittavaikutus on perifeerinen kasvohermohalvaus. Se johtuu kasvohermon toiminnan ohimenevästä häiriöstä aivojen ulkopuolisella alueella. Sille ei monesti ole osoitettavissa selkeää syytä, mutta sitä tiedetään esiintyvän myös eräiden muiden rokotusten jälkeen. Kasvohermohalvaus paranee yleensä itsestään ajan myötä, mutta paranemista voidaan edistää kortisonihoidolla.
Haittavaikutuksista ilmoittaminen
Myyntiluvan myöntämisen jälkeen lääkkeiden ja rokotteiden turvallisuudesta kertyy tietoa useista lähteistä, joista yksi keskeisimmistä ovat haittavaikutusilmoitukset. Haittavaikutusilmoitusjärjestelmä on lääketurvallisuuden työkalu, jonka tärkein tarkoitus on havaita signaaleja eli merkkejä mahdollisista uusista haittavaikutuksista. Kuten mikä tahansa työkalu, se palvelee parhaiten sitä tarkoitusta, jota varten se on rakennettu, ja toisaalta vastaa puutteellisesti tai ei lainkaan muihin kysymyksiin.
Epäillyistä haittavaikutuksista voivat ilmoittaa sekä terveydenhuollon ammattilaiset että rokotteen saaneet kansalaiset. Erityisesti kehotetaan ilmoittamaan sellaisista haittavaikutuksista, jotka ovat vakavia tai odottamattomia - eli niitä ei mainita valmisteen tuotetiedoissa.Ilmoittaminen on vapaaehtoista, ja ilmoitukset kuvastavat ilmoittajien havaintoja ja näkemyksiä epäillyistä haitoista.
Haittavaikutusilmoitus tehdään täyttämällä Fimean verkkosivulta löytyvä haittavaikutusilmoituslomake, ja lähettämällä se Fimeaan. Rokotteita koskevissa ilmoituksissa on erityisen tärkeää kirjata valmisteen tuotenimi, sekä valmisteen eränumero, jos se on ilmoittajan tiedossa.
Haittavaikutusten rekisteröinti
Kaikki Suomessa ilmoitetut lääkkeiden ja rokotteiden haittavaikutukset tallennetaan Fimean haittavaikutusilmoitusrekisteriin. Ilmoitusten tiedot koodataan rakenteiseen muotoon, ja niistä arvioidaan mm. haitan vakavuus, odotettavuus ja rokotteen myyntilupaan kohdistuvien jatkotoimenpiteiden tarve.
Fimea lähettää rokotteiden haittavaikutustiedot Euroopan lääkeviraston EudraVigilance-tietokantaan, jonka kautta rokotteen myyntiluvan haltija saa ne. Koronarokotteet löytyvät tietokannasta vaikuttavan aineen mukaisesti kohdasta ”COVID-19”.
Koska haittavaikutuksista ilmoittaminen perustuu vapaaehtoisuuteen, järjestelmän perusteella ei saada kattavaa kuvaa haittavaikutusten esiintyvyydestä. Tätä voidaan selvittää paremmin esimerkiksi kliinisillä lääketutkimuksilla tai epidemiologisilla tutkimuksilla. Eri lähteistä kertyvän tiedon valossa punnitaan rokotteen hyöty-haittatasapainoa väestötasolla.
Kansallisten toimijoiden, EMA:n ja myyntiluvan haltijoiden roolit
Haittavaikutussignaalien etsiminen on lakisääteistä lääketurvatoimintaa, jota tehdään myyntiluvan saamisen jälkeen kaikille lääkkeille. Rokotteet eivät tässä suhteessa poikkea lääkkeistä. Fimean lisäksi kansallisella tasolla rokotteiden haittavaikutuksia seuraa Terveyden ja hyvinvoinnin laitos, joka kartoittaa terveydenhuollon kansallisia tietokantoja mahdollisten signaalien löytämiseksi (kuvio 1).
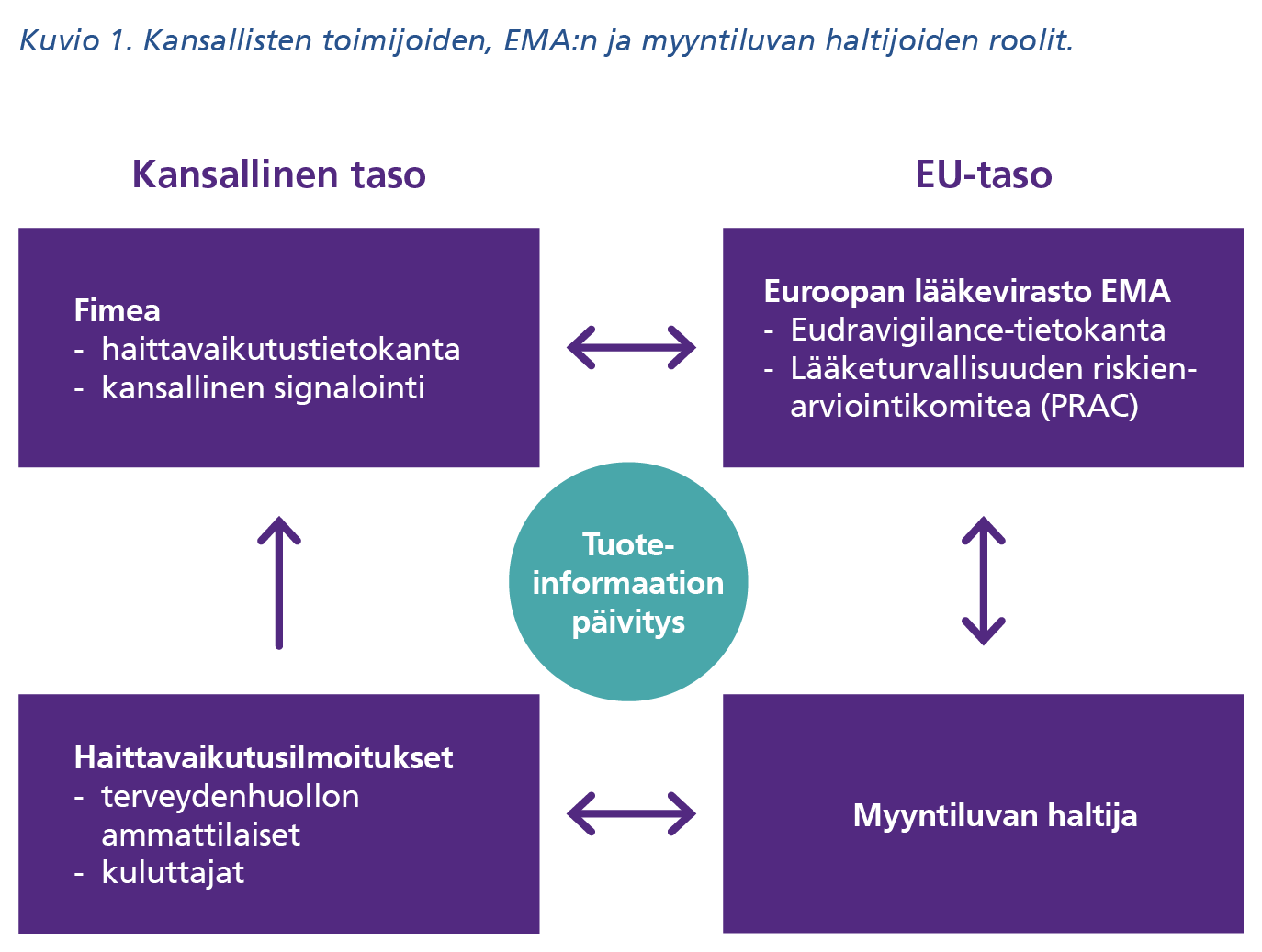
Ylikansallisella tasolla lääkkeiden ja rokotteiden haittavaikutusten seurannasta vastaavat Euroopan lääkevirasto (EMA) ja rokotteiden myyntiluvan haltijat. Koronarokotteet on hyväksytty koko Euroopan unionin alueella ns. keskitetyllä myyntilupamenettelyllä, jota käytetään uusille bioteknologisille lääkkeille. Tällaisten valmisteiden kohdalla EMA tekee keskitettyä haittavaikutusseurantaa jäsenmaidensa alueella.
Myyntiluvan haltija puolestaan seuraa tilannetta oman haittavaikutusjärjestelmänsä kautta maailmanlaajuisesti niissä maissa, joissa sen rokotteella on myyntilupa. Koronaviruspandemian aikana myyntiluvan haltijat raportoivat koronarokotteiden haittavaikutusseurannan tulokset kuukausittain EMAlle.
Signaalien etsintä ja arviointi
Signaalien etsiminen on jatkuvaa ja aktiivista toimintaa. Kun mahdollinen signaali havaitaan, arvioidaan, onko rokotteen ja haittavaikutuksen välillä syy–seuraussuhde. Tätä tukevat useat samaa haittaa käsittelevät raportit, altistusajankohdan sopivuus, todennäköinen haittamekanismi, vaihtoehtoisten syiden puuttuminen, sekä uudelleenaltistuksen aiheuttama samankaltainen haitta.
Haittavaikutusta arvioitaessa otetaan huomioon myös reaktion voimakkuus, siitä toipuminen, sekä sen esiintyminen erityisryhmissä, kuten lapsilla, maksan tai munuaisten vajaatoiminnasta kärsivillä tai immuunipuutteisilla potilailla.
Havaitut ja vahvistetut signaalit viedään EMAn Lääketurvallisuuden riskinarviointikomitean (PRAC) arvioitavaksi. Komitea arvioi muun muassa myyntiluvan haltijan maailmanlaajuisen haittavaikutustietokannan tietoja ja lääketieteellistä kirjallisuutta. Arvion jälkeen PRAC antaa suosituksen toimenpiteistä, joita voivat olla valmisteyhteenvedon päivittäminen, lääketurvallisuustiedote terveydenhuollon ammattilaisille tai signaalin tehostettu seuranta lääkevalmisteen määräaikaisissa turvallisuuskatsauksissa.
Ehdollinen myyntilupa ja tietojen julkisuus
Koronarokotteiden teho ja turvallisuus on osoitettu ennen myyntiluvan myöntämistä tehdyissä tutkimuksissa. Myyntiluvat on myönnetty ehdollisina, koska rokotteille on selkeä lääketieteellinen tarve, mutta tutkimustietoa tavallisen myyntiluvan myöntämiseksi ei ole vielä riittävästi. Ehdolliseen myyntilupaan sisältyy velvoite toimittaa EMAlle rokotteiden laatua ja valmistusprosesseja koskevia lisätietoja ja raportoida säännöllisesti meneillään olevien seurantatutkimusten tuloksia.
Kaikille myyntiluvallisille koronarokotteille on määritelty tutkimusohjelmat, joissa selvitetään rokotteiden tehoa ja turvallisuutta niitä jo saanneilla ja jatkossa saavilla ihmisillä. Tutkimukset kestävät useita vuosia, mutta niistä julkaistaan väliraportteja jo tämän vuoden aikana. Tutkimuksissa huomioidaan myös erityisryhmät, kuten immuunipuutteiset, raskaana olevat ja korkean riskin potilaat, joita ei ole osallistunut ennen myyntiluvan myöntämistä tehtyihin tutkimuksiin.
Osa rokotteiden myyntilupia, tehoa ja turvallisuutta koskevista tiedoista on julkisia. Kun myyntilupa on myönnetty, valmistekohtaisella EPAR-verkkosivulla julkaistaan yhteenveto rokotteesta, sen tuotetiedot, riskienhallintasuunnitelma, tehtyihin arviointeihin liittyviä asiakirjoja ja kuukausittainen turvallisuuskatsaus. Julkista tietoa ovat myös myyntilupa-arvioinnissa olevat vaikuttavat aineet, signaaliarvioihin pohjautuvat suositukset ja lähetemenettelyissä (referrals) käsitellyt asiat.
Vakavan haittavaikutuksen kriteerit
Haittavaikutus on vakava, jos se on:
- johtanut kuolemaan
- aiheuttanut hengenvaaran
- vaatinut sairaalahoitoa tai pidentänyt sitä (sairaalahoidolla tarkoitetaan osastohoitoa, ei esim. käyntiä päivystyspoliklinikalla)
- aiheuttanut pysyvän vamman tai merkittävän toimintakyvyn laskun (merkittävällä toimintakyvyn laskulla tarkoitetaan esim. pysyvä tai pitkäaikainen työkyvyttömyys)
- aiheuttanut synnynnäisen epämuodostuman tai muun synnynnäisen poikkeavuuden
Haittavaikutusilmoituksen tekeminen
1. Täytä haittavaikutusilmoituslomake:
ilmoita rokotteen tuotenimi ja eränumero
FiMnet-tunnuksia käyttämällä voi täyttää sähköisen ilmoituslomakkeen
2. Lähetä lomake postitse:
Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
tai Fimean turvasähköpostilla:
Lue lisää: Haittavaikutusilmoituksen tekeminen (Fimea)


