Vuonna 2018 Fimea sai yhteensä 5 393 haittavaikutusilmoitusta, joista noin 16 % koski rokotteita ja loput muita lääkkeitä.

Haittavaikutusilmoitusjärjestelmän tarkoitus on havaita signaaleja eli merkkejä mahdollisista uusista haittavaikutuksista. Epäillyistä haittavaikutuksista voivat ilmoittaa sekä terveydenhuollon ammattilaiset että lääkkeiden käyttäjät.
Ilmoittaminen on vapaaehtoista, ja ilmoitukset kuvastavat ilmoittajan havaintoja ja näkemyksiä epäillystä haitasta. Järjestelmän perusteella ei saada kattavaa kuvaa haittavaikutusten esiintyvyydestä. Tätä voidaan selvittää paremmin esimerkiksi kliinisillä lääketutkimuksilla tai epidemiologisilla tutkimuksilla. Eri lähteistä kertyvän tiedon valossa punnitaan lääkkeen hyöty-haittatasapainoa väestötasolla.
Haittavaikutustietokantaan tallennetaan kaikki Fimeaan ilmoitetut lääkkeiden ja rokotteiden haittavaikutukset.Fimea lähettää tiedot edelleen Euroopan lääkeviraston EudraVigilance-tietokantaan (EV, jonka kautta epäillyn lääkkeen tai rokotteen myyntiluvan haltija sekä Maailman terveysjärjestön (WHO) haittavaikutusrekisteri saavat ilmoitukset tietoonsa.
Tartuntatautilain muutoksen myötä rokotteiden haittavaikutusilmoitusten vastaanottaminen siirtyi Terveyden ja hyvinvoinnin laitokselta (THL) Fimeaan maaliskuussa 2017. THL ja Fimea seuraavat rokotteiden turvallisuutta yhteistyössä. Rokotteet olivat ensimmäistä kertaa mukana Fimean haittavaikutusilmoitusten vuoden 2017 vuosikatsauksessa.
EU:ssa siirryttiin uuteen EV-järjestelmään haittavaikutusilmoitusten seurannassa vuonna 2017. Ennen tätä myyntiluvan haltijat lähettivät Suomesta vastaanottamansa vakavat ilmoitukset Fimeaan, joka lähetti ne EV-tietokantaan. Uudessa järjestelmässä myyntiluvan haltijat eivät enää lähetä ilmoituksia Fimeaan, vaan suoraan EV-tietokantaan, ja Fimea saa ne tietoonsa EV-tietokannan kautta.
Uuden EV-järjestelmän myötä myös ei-vakavat myyntiluvan haltijalle ilmoitetut haittavaikutukset lähetetään EV-tietokantaan. Tämä lisäsi Fimeassa käsiteltävien ilmoitusten määrän vuositasolla noin kaksinkertaiseksi.
Näistä ilmoitusliikenteen muutoksista johtuen ilmoitusmäärät eivät ole suoraan verrattavissa aiempiin vuosiin. Koska suurin lisäys ilmoitusten määrässä johtuu myyntiluvan haltijan tietoon tulevista ei-vakavista ilmoituksista, on nyt eniten ilmoitettujen valmisteiden joukossa esimerkiksi insuliinivalmisteita, joissa usein tuotteen käyttöön tai säilytykseen liittyvien yhteydenottojen perusteella syntyy myös haittavaikutusilmoitus. Myös kuluttajailmoitusten osuuden lisääntyminen johtuu osittain tästä muutoksesta.
Haittavaikutusilmoitukset vuonna 2018
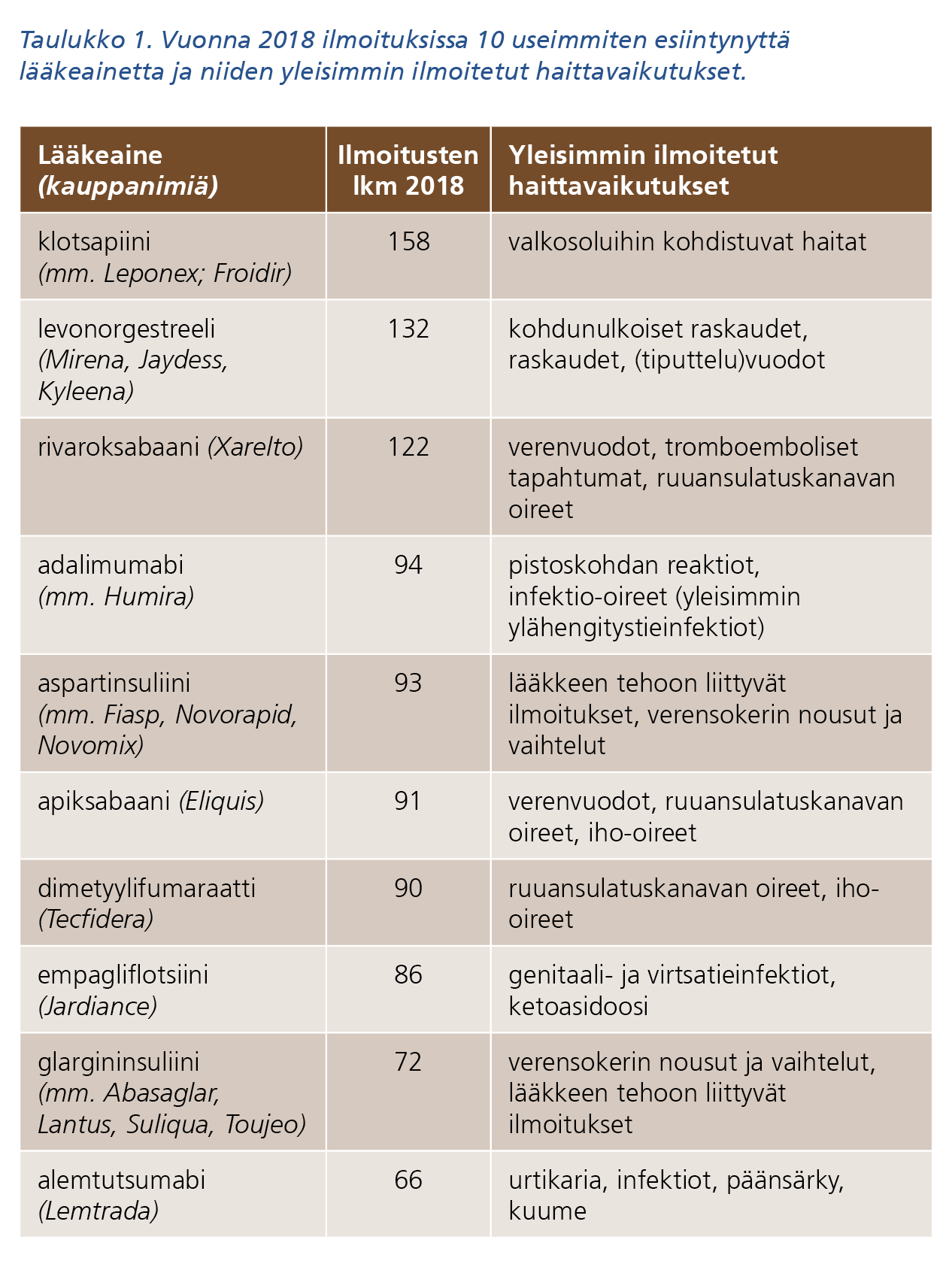
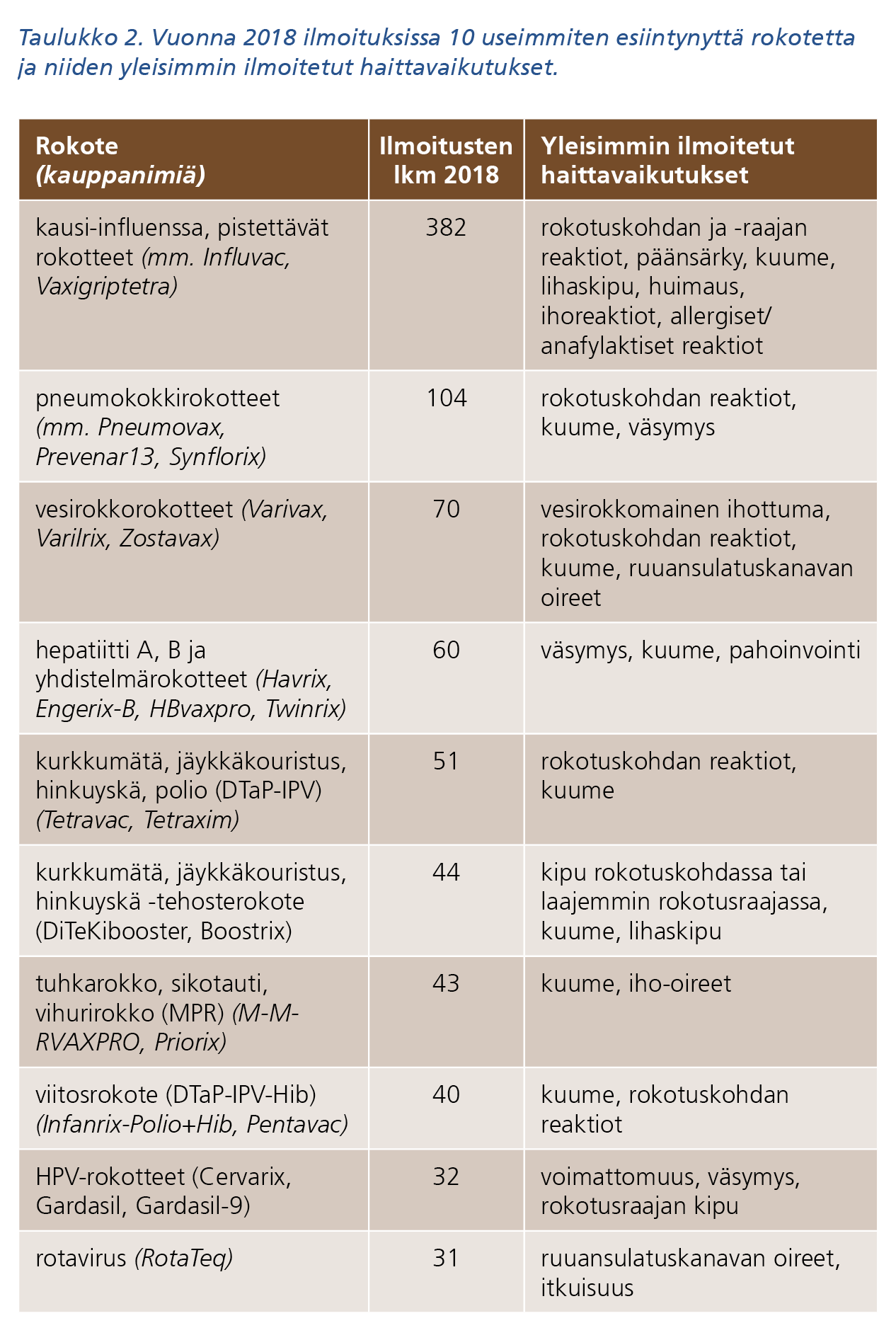
Fimea sai 5 393 haittavaikutusilmoitusta vuonna 2018. Ilmoituksista 857 koski rokotteiden haittavaikutuksia. Epäiltyjä vaikuttavia aineita ilmoituksissa oli yhteensä 709, joista rokotteita 31. Näistä vaikuttavista aineista noin 80 %:sta saatiin alle 10 ilmoitusta. Noin kolmannes (33 %) kaikista ilmoituksista keskittyi taulukoissa 1 ja 2 esitettyihin lääkevalmisteisiin tai rokotteisiin (10 useimmiten ilmoituksissa esiintynyttä lääkevalmistetta/rokotetta).
Taulukon 1 tekstivastine saavutettavassa muodossa (pdf).
Taulukon 2 tekstivastine saavutettavassa muodossa (pdf).
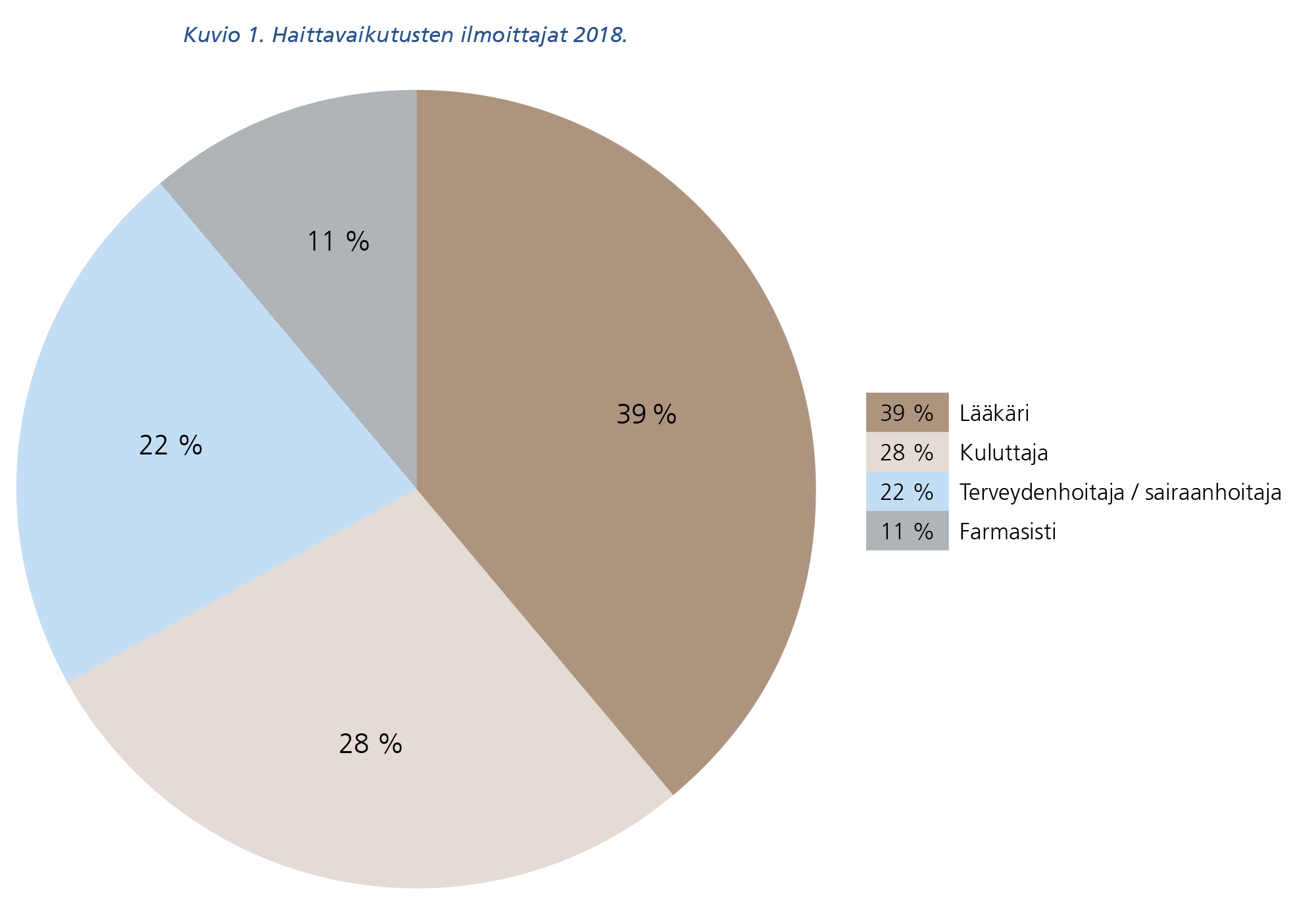
Kaikista haittavaikutusilmoituksista 39 % oli peräisin lääkäreiltä, 28 % kuluttajilta, 22 % terveyden- tai sairaanhoitajilta ja 11 % apteekkihenkilökunnalta (kuvio 1). Rokotteiden haittavaikutusilmoituksista 65 % tuli terveyden- ja sairaanhoitajilta, 20 % kuluttajilta ja 15 % lääkäreiltä.
Kuvion 1 tekstivastine saavutettavassa muodossa (pdf).
5 393 ilmoituksessa oli yhteensä 17 420 epäiltyjä haittavaikutusta. 30 %:ssa ilmoituksista ainakin yksi kuvatuista haittavaikutuksista oli luokiteltu vakavaksi (johtanut esim. hengenvaaraan, sairaalahoitoon tai toimintakyvyn alenemiseen).
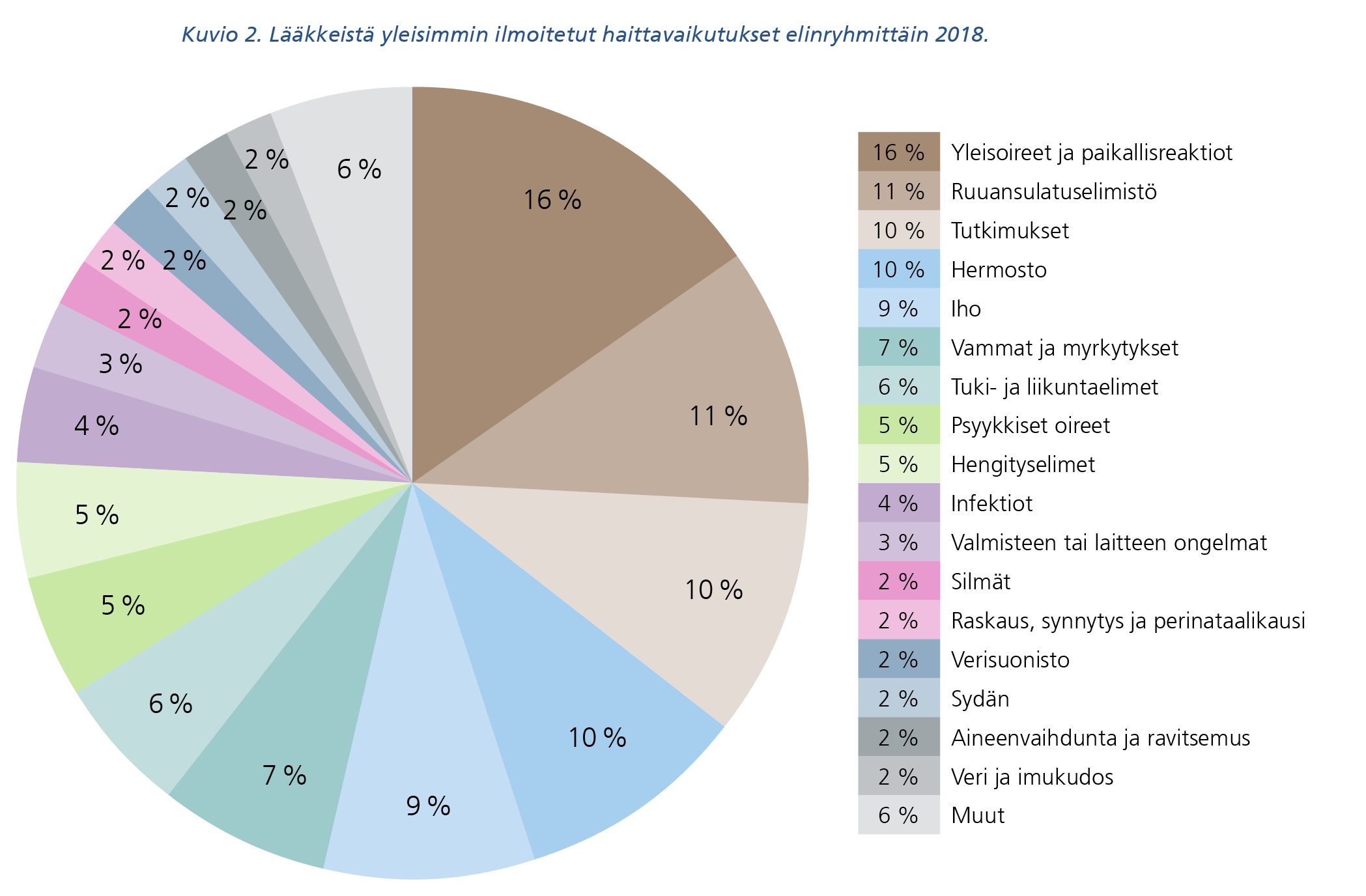
Lääkkeistä eniten ilmoitettiin yleisoireista ja lääkkeen antopaikkaan kohdistuvista oireista, sekä ruuansulatuselimistöön, hermostoon tai ihoon kohdistuvista haitoista sekä erilaisten (laboratorio)testitulosten poikkeamista (kuvio 2). Lääkkeillä yleisimmin ilmoitettuja haittavaikutuksia olivat pahoinvointi, väsymys, päänsärky ja ripuli.
Kuvion 2 tekstivastine saavutettavassa muodossa (pdf).
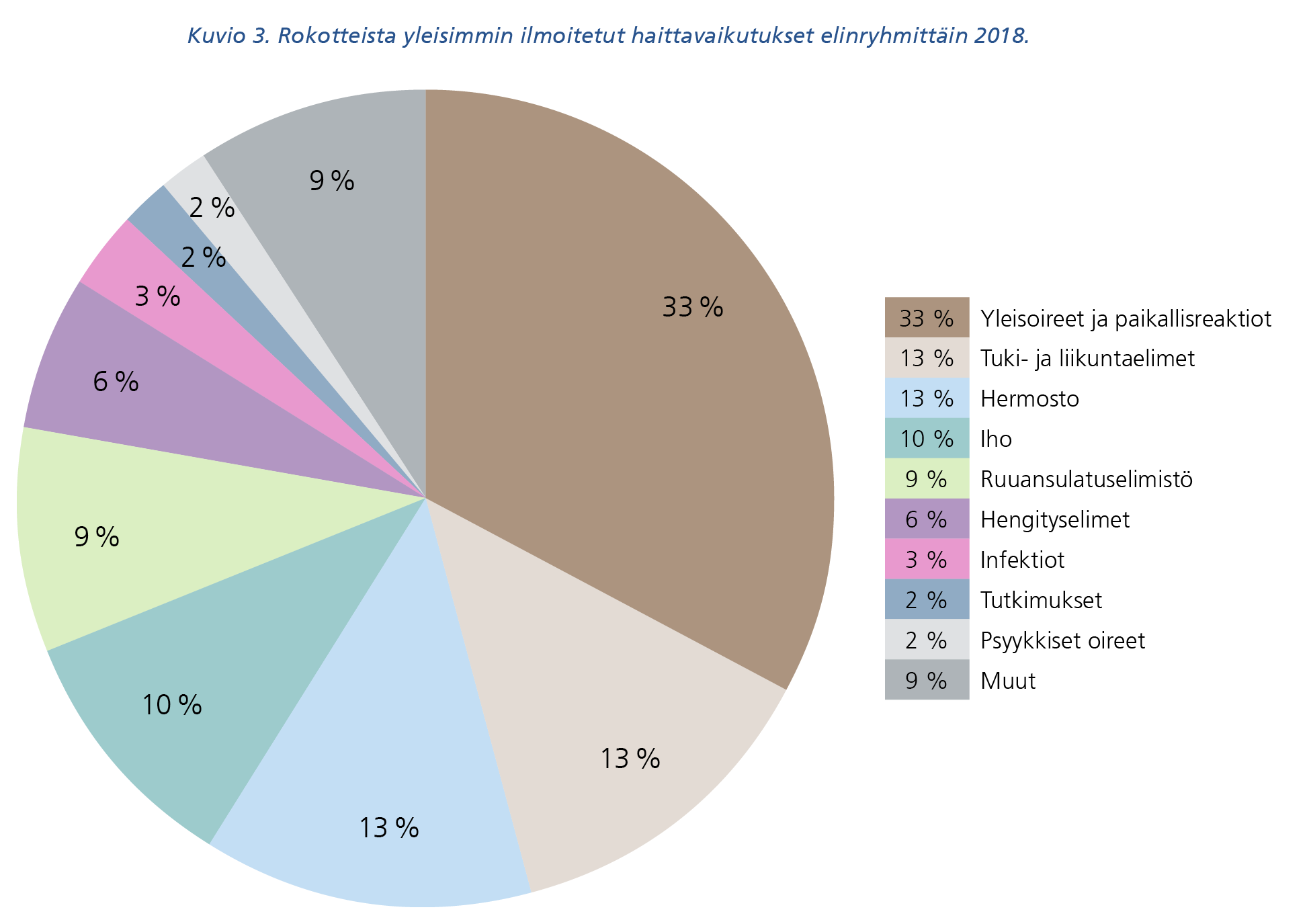
Rokotteista eniten ilmoitettiin yleisoireista ja lääkkeen antopaikan reaktioista, tuki- ja liikuntaelimistön tai hermoston oireista sekä iho-oireista (kuvio 3). Rokotteilla yleisimmin ilmoitettuja haittavaikutuksia olivat erilaiset rokotuskohdan reaktiot, kuume ja kipu rokotusraajassa.
Kuvion 3 tekstivastine saavutettavassa muodossa (pdf).