Lääkeviranomaiset valvovat lääketuotantoa maissa, joista tuodaan lääkevalmisteita Eurooppaan. Huolena on lääkeaineiden päätyminen ympäristöön tuotantoalueilla. Esimerkiksi Intiassa on havaittu korkeita antibioottipitoisuuksia lääketehtaiden ympäristön vesistöissä. Voitaisiinko asiaan puuttua lääketuotannon valvonnan keinoin?

Fimea valvoo lääkkeiden valmistusta, maahantuontia ja jakelua sekä varmistaa että lääketehtaat, lääketukkukaupat, apteekit ja sairaala-apteekit noudattavat Euroopan unionin ja Suomen lääkelainsäädäntöä. Lääketehdastarkastukset ovat osa tätä toimintaa.
Lääkkeet päätyvät ympäristöön eri tavoin
Euroopan komissio on arvioinut, että lääkeaineet joutuvat EU-alueella ympäristöön kotitalouksien, tuotantoeläinlaitosten ja maataloustuotannon normaalin käytön seurauksena (kuvio 1). Lääkkeiden käytön lisäksi lääkeaineita voi joutua ympäristöön myös lääkkeiden tuotanto- ja jakelulaitosten, kliinisten ja kemiallisten laboratorioiden, sairaaloiden ja apteekkien kautta.
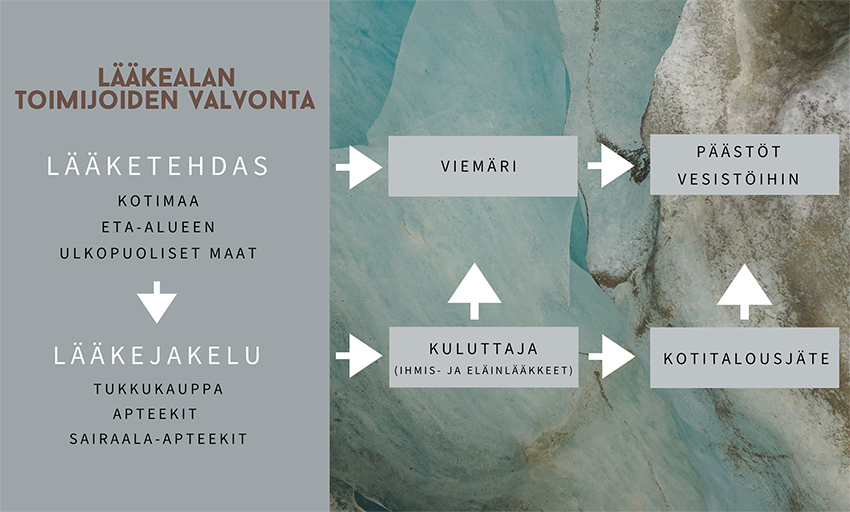
Ympäristössä lääkeaineet voivat aiheuttaa suoria vaikutuksia luonnonvaraisille eläimille. Huolta on herättänyt myös ympäristöön joutuneiden antibioottien vaikutus antibioottiresistenssiin.
Lääketeollisuuden valvonta ETA-alueella ja sen ulkopuolella
Euroopan talousalueella (ETA) myytävien lääkkeiden teollisessa valmistuksessa on valmistusmaasta riippumatta noudatettava EU:n lääkkeiden hyviä tuotantotapoja (good manufacturing practices, GMP) tai vähintään niitä vastaavia GMP-standardeja.
GMP kattaa ne tuotannon ja laadunvalvonnan toimenpiteet, joilla varmistetaan lääkkeen korkea laatu lääkkeen käyttäjälle. Lääkevalmistetehtaat vastaavat siitä, että niiden omassa toiminnassa noudatetaan GMP:n vaatimuksia, ja ne vastaavat myös siitä, että heidän sopimusvalmistajansa ja -laboratorionsa sekä lääkeainevalmistajat noudattavat GMP-vaatimuksia.
ETAn jäsenmaiden lääkeviranomaiset tarkastavat säännöllisesti alueellaan sijaitsevat lääkevalmistetehtaat ja ne lääkevalmistetehtaat ETAn ulkopuolella, joista tuodaan lääkeitä ETA-alueelle, ellei maalla ole EU:n kanssa sopimusta tarkastuksien vastavuoroisesta tunnustamisesta (MRA).
Vaikuttavien aineiden (lääkeaineiden) teollinen tuotanto ei ole säännöllisten ETA-viranomaistarkastusten piirissä biologisia ja steriilejä lääkeaineita lukuun ottamatta.
Lääkeainetehtaan GMP:n mukaisuuden varmistamisesta vastaa lääkeainetta käyttävä lääkevalmistetehdas, jonka velvollisuus on auditoida lääkeainevalmistajansa tuotantotoiminta. Lääkeainetehtaisiin tehdään viranomaistarkastuksia vain riskiperusteisesti ja erityisistä syistä esimerkiksi lääkkeiden saatavuuden varmistamiseksi.
Koska GMP-vaatimusten tarkoitus on varmistaa lääkkeen laatua, lääketehtaissa lääkejätteiden (vanhentunut tai muutoin jatkoprosessointiin ja myyntiin kelpaamaton tuotanto) osalta GMP-valvonta kohdistuu ristikontaminaatio- ja lääkeväärennösriskien pienentämiseen. Lääketehtaiden on itse huolehdittava, että lääkejätteet eivät sekoitu myytävien lääkkeiden kanssa lääketehtaassa (ristikontaminaatio) ja että tehtaan lääkejätteet tai painettu pakkausmateriaali eivät pääse lääketehtaasta laittomasti jakeluun (lääkeväärennösriski).
Lääketehtailta edellytetään, että niillä on selkeä ohjeistus jätteiden käsittelystä (jätteet on säilytettävä erillään muusta tuotannosta ja ne merkitään selkeästi). Lisäksi pitää varmistaa, että ulkopuoliset eivät pääse tuotantotiloihin.
Keskittynyt lääketuotanto aiheuttaa muun muassa ympäristöongelmia – erityisenä haasteena antibioottiresistenssi
Uudella mekanismilla vaikuttavia antibiootteja ei ole tullut markkinoille viime aikoina, ja geneeristen antibioottien tuotanto on käytännössä siirtynyt liiketaloudellisin periaatteiden mukaisesti halvempien tuotantokustannusten vuoksi EU:n ulkopuolelle. Antibioottien tuotanto on keskittynyt etupäässä Intiaan, ja jonkin verran myös Kiinaan.
Esimerkiksi Intiassa on mitattu päästöjen aiheuttamia korkeita antibioottipitoisuuksia lääketehtaiden ympäristön vesistöissä. Lääketehtaiden lähistön ympäristöbakteereista on löydetty myös muun muassa ESBL- ja karbapenemaasia tuottavia suolistobakteereita.
Erityistä huolta aiheuttavat viitteet siitä, että mikrobilääkkeiden tuotantolaitoksilta peräisin olevat päästöt edistävät mikrobilääkeresistenssin maailmanlaajuista kehittymistä ja leviämistä.
Lääkevalvonnan haasteena on se, että nykyinen lainsäädäntö ei anna riittävästi työkaluja näihin ongelmiin puuttumiseksi.
Nykyinen lääkelainsäädäntö ei edellytä myöskään valmistusmaan merkintää lääkepakkaukseen. Lääkkeen käyttäjä ei voi valita tietyssä maassa valmistettua lääkettä ja näin vaikuttaa käyttämänsä lääkkeen ympäristöystävällisyyteen. Joskin antibioottien valmistus on niin keskittynyttä, että kuluttajalla tai lääkkeen määrääjällä ei ole todellista mahdollisuutta valita ympäristöystävällinen valmiste, vaikka valmistusmaa pakkauksiin olisikin merkitty.
Fimea on ollut aktiivisesti mukana ottamassa esille näitä EU-lainsäädäntöpuutteita tilanteen korjaamiseksi.
Muuntogeenisten tuotto-organismien käyttöä lääketeollisuudessa valvotaan
Muuntogeenisten organismien (GMO) avulla tuotetaan lääkeaineita, joita ei voida valmistaa kemiallisten prosessien avulla (esim. hormoneja, kasvutekijöitä ja vasta-aineita).
Geenitekniikan avulla voidaan myös lisätä esimerkiksi home- tai bakteerikantojen kykyä tuottaa suuria määriä antibiootteja teollisen mittakaavan kasvatusolosuhteissa. Fimea valvoo lääkevalmisteisiin liittyvien GM-organismien ympäristövaikutuksia Suomessa geenitekniikkalain mukaisesti.
GM-tuotantokantojen käyttö ei sinänsä lisää antibioottiresistenssin leviämisen vaaraa, kun tuotannossa noudatetaan asianmukaisia toimenpiteitä. Tällöin esimerkiksi käytetään GM-kantoja, jotka eivät lisäänny ympäristössä eivätkä siirrä perintöainestaan luonnonkantoihin.
Suomessa myös GM-organismien pääsy ympäristöön estetään lääketeollisuuden GM-organismeja hyödyntävien tuotantoprosessien ja niihin liittyvän jätehuollon aikana.
EU:n lääkelainsäädäntöä uudistetaan
EU:n lääkelainsäädäntöä kehitetään parhaillaan lääkkeiden ympäristövaikutusten osalta. Euroopan komissio julkaisi vuonna 2019 lääkestrategian, jonka tavoitteena on muun muassa vähentää lääkkeiden ympäristövaikutuksia lääkkeen koko elinkaaren aikana.
Mikä voisi olla lääketehdastarkastusten rooli antibioottiresistenssin torjunnassa? Haaste on hyvin moniulotteinen (mm. Lauhio, ym., tässä numerossa) eikä tilanteeseen ole yhtä ainutta ratkaisua.
Tehdastarkastusten kehittäminen voisi olla yksi keino muiden joukossa hallita kasvavaa antibioottiresistenssihaastetta. Erityisesti Ruotsi on avannut keskustelua siitä, pitäisikö lääkkeiden ympäristövaikutusten arviointi liittää osaksi lääketehtaiden tarkastuksia – tämä edellyttäisi kaikkien EU-jäsenmaiden enemmistön hyväksyntää.
Lääketuotannon valvonta rahoitetaan lääketehtailta ja myyntiluvanhaltijoilta perittävillä valvontamaksuilla, joten valvonnan lisääntyminen ja ympäristönäkökohtien painoarvon kasvaminen lääkkeiden laadun, tehon ja turvallisuuden ohessa todennäköisesti heijastuisi jollain aikavälillä lääkkeiden hintoihin. Päätettäväksi jää, millaisen painoarvon ympäristöasia tulevaisuudessa saa.
Lainsäädäntö ja normit
Direktiivi 2001/83/EY
Direktiivi 2003/94/EY
Jätelaki 2011/646 32§
Lääkelaki 395/1987
Fimean määräys 3/2019: Lääkevalmisteen myyntipäällysmerkinnät ja pakkausseloste
Fimean määräys 5/2019: Lääkkeiden hyvät tuotantotava
Kirjallisuutta
EU guidelines to good manufacturing practice. Medicinal products for human and veterinary use.
Good practices for take-back and disposal of unused pharmaceuticals in the Baltic Sea region Clear Waters from Pharmaceuticals (CWPharma) Activity 4.1 Report
Komission tiedonanto Euroopan parlamentille, neuvostolle ja Euroopan talous- ja sosiaalikomitealle. Euroopan unionin strateginen lähestymistapa ympäristössä oleviin lääkeaineisiin.
Lübbert C, ym. Environmental pollution with antimicrobial agents from bulk drug manufacturing industries in Hyderabad, South India, is associated with dissemination of extended-spectrum beta-lactamase and carbapenemase-producing pathogens. Infection 2017; 45, 479–491.
Suomen Ympäristökeskus. Lääkejäämiä sisältävän jäteveden puhdistuksen tehostaminen päästölähteillä ja lääkejätteen tehokkaampi käsittely (EPIC).
Lääkkeet loppuvat, kun Kiina sulkee tehtaita. Apteekkari.
Maailmalla hamstrataan nyt täyttä häkää lääkkeitä – Suomen antibioottivarastot riittävät pahassakin tapauksessa kuukausiksi. Kauppalehti.
Miten huomioida lääkkeiden ympäristövaikutukset terveydenhuollon arjessa? Lääketietokeskus.
Teräsalmi E, ym. Lääkkeiden ympäristövaikutusten hallinta sääntelyn avulla. Dosis 2020; 3.


