Hoidon yksilöllistämiseen tarvittavat tekniset edellytykset ovat olemassa, mutta potilaskohtaisen suuren tietomäärän integraatio, tulkinta ja implementaatio on vielä haasteellista. Tutkimusten ja lääkkeiden saatavuus ja kustannusten kattaminen vaativat laajaa pohdintaa terveydenhuollon prioriteeteista.

Molekylaarisiin poikkeavuuksiin kohdentuva täsmälääkehoito on ottanut suuria harppauksia, ja lähes sairauteen kuin sairauteen on nyt tarjolla taudin perusbiologiaan vaikuttavia, usein suun kautta otettavia lääkkeitä.
Etenkin syöpätaudeissa yksilöllistetyn hoidon kehitys on ollut nopeaa. Kasvainten genominen profilointi on maailmanlaajuisesti miljardiluokan liiketoimintaa, ja myös Suomessa kasvainkohtaisten geenipaneelien saatavuus on melko hyvä ja kehitystyö ripeää.
Vaikka tietämys ja osaaminen lisääntyvät nopeasti, geenipohjaisten lähestymistapojen yksi keskeinen ongelma on siinä, että todettujen mutaatioiden kliininen merkitys, etenkin lääkehoitoa koskien, on usein epäselvä tai tuntematon. Lisäksi lähes poikkeuksetta kasvaimissa on useita ajurimutaatioita ja useita eri klooneja samanaikaisesti, jolloin yhteisvaikutuksen arviointi on hyvin haastavaa.
Geenipaneelien rajoitteiden vuoksi kasvainten profilointiin liitetään usein funktionaalisia määrityksiä, kuten koeputkessa tai soluviljelmässä potilassoluilla tehtävää ex vivo -lääkeherkkyystutkimusta tai esimerkiksi massasytometriaan perustuvia dynaamisia testauksia. Tavoitteena on parantaa profiloinnin ennustavuutta lääkevasteiden osalta.
Yksilöllistetyn hoidon saavutuksista ja haasteista
HUS Syöpäkeskus ja Suomen molekyylilääketieteen instituutti (FIMM) toteuttivat laajan yhteistyöprojektin, jossa profiloitiin kaikki vuosina 2011–2018 vastatodetut tai uusiutuneet akuutit myeloidiset leukemiataudit. Tutkimuksessa kartoitettiin potilaiden (n = 252) leukemiasolut käyttämällä geneettisiä (koko eksomin ja transkriptomin sekvensointi: somaattiset ja ituradan muutokset) ja funktionaalisia (ex vivo -lääkeherkkyystutkimus, yli 500 lääkemolekyyliä) menetelmiä.
Tavoitteena oli tutkia taudin biologiaa ja löytää uusia hoitoja uusiutunutta AML-tautia sairastaville potilaille, joiden ennuste on hyvin huono.
Profilointitutkimuksista ex vivo -lääkeherkkyystutkimus oli kliinisesti käyttökelpoisin, koska sen avulla > 80 %:lle potilaista löytyi 1–4 potentiaalisesti tehokasta lääkettä. Lisäksi etuna oli tutkimuksen nopeus (vastausaika 4 vrk), mikä on tärkeää nopeasti etenevässä taudissa. Osoitimme, että toisen käyttöaiheen omaava lääke voi olla tehokas myös tietyissä leukemiamuodossa, ja tällöin tämä tie (drug repurposing) olisi nopein tapa saada uusi lääke kliiniseen käyttöön.
Lisäksi löysimme useaan akuutin leukemian alaryhmään uusia lääkevaihtoehtoja, joita voidaan kehittää edelleen kliinisissä lääketutkimuksissa.
Pystyimme hyödyntämään profilointitietoja 26:n uusiutunutta AML-tautia sairastavan potilaan hoidossa, joilla ei ollut muuta hoitoa tarjolla. Noin 40 % hoidetuista potilaista hyötyi hoidosta objektiivisesti, mutta hoitovasteet olivat lyhyitä (1–2 kk), eikä hoidolla ollut merkittävää vaikutusta pitkälle edenneen taudin kulkuun.
Miksi edellä olleen esimerkin mukaisen yksilöllistetyn syöpähoidon teho oli melko vaatimaton? Yksi ilmeinen syy on potilasmateriaali: potilaat sairastivat pitkälle edennyttä syöpää ja olivat saaneet useita aikaisempia hoitoja. Toisaalta uusia hoitoja kaivataan juuri potilaille, joille standardihoito ei ole ollut riittävän tehokasta. Ehkäpä keskeinen haaste on kuitenkin lääkkeiden saatavuus.
Vain osa lääkkeistä oli kliinisesti käyttökelpoisia ja niilläkin myyntiluvan mukainen käyttöaihe on muussa kuin AML-taudissa. Lähes kaikkien testattujen leukemiasolunäytteiden tilanne oli samanlainen: suurin osa potentiaalisesti tehokkaista lääkkeistä oli ei-myyntiluvallisia, lääketutkimusvaiheessa olevia molekyylejä. Näiden lääkkeiden saanti lääkeyrityksiltä yksittäisten potilaiden hoitoon on vaikeaa tai jopa mahdotonta, vaikka kyse olisi myöhäisessä kehitysvaiheessa (Faasi III) olevasta molekyylistä. Lisäksi parhaimman tehon saavuttamiseksi olisi aiheellista käyttää yhdistelmähoitoja, usein eri valmistajilta.
Miten eteenpäin?
Taudin tarkan profiloinnin kustannukset ovat merkittäviä, mutta kuitenkin vain murto-osa verrattuna annettuun lääkitykseen. Laaja geneettinen ja funktionaalinen profilointi tuottaa jokaisesta potilaasta niin valtavia määriä tietoa, että sen käsittelyyn ei ole valmiuksia etenkään sairaalaympäristössä. Eri tietolähteiden (mm. kliiniset muuttujat, sekvensointi-ja lääkeherkkyystutkimusdata) tehokas ja järkevä integrointi sekä analyysi päätöksenteon tueksi vaatii paljon kehitystyötä ja uudentyyppistä analytiikkaa, johon muun muassa syvä koneoppiminen (deep learning) voi tuoda merkittävää apua.
Päätöksenteon tulisi perustua hyvin suunniteltuihin ja testattuihin asiantuntijajärjestelmiin, joiden keskeiset parametrit olisivat kuitenkin tunnettuja. Kansalliset (jopa kansainväliset) moniammatilliset tuumoriryhmät ovat keskeisiä yksilöllistetyn hoidon toteuttajia ja tae sille, että kaikki potilaat ovat samanarvoisessa asemassa, eikä hoidon saatavuus riipu hoitavasta yksiköstä (kuvio 1). Myös potilaiden tulee olla keskeinen osa päätöksentekoketjua.
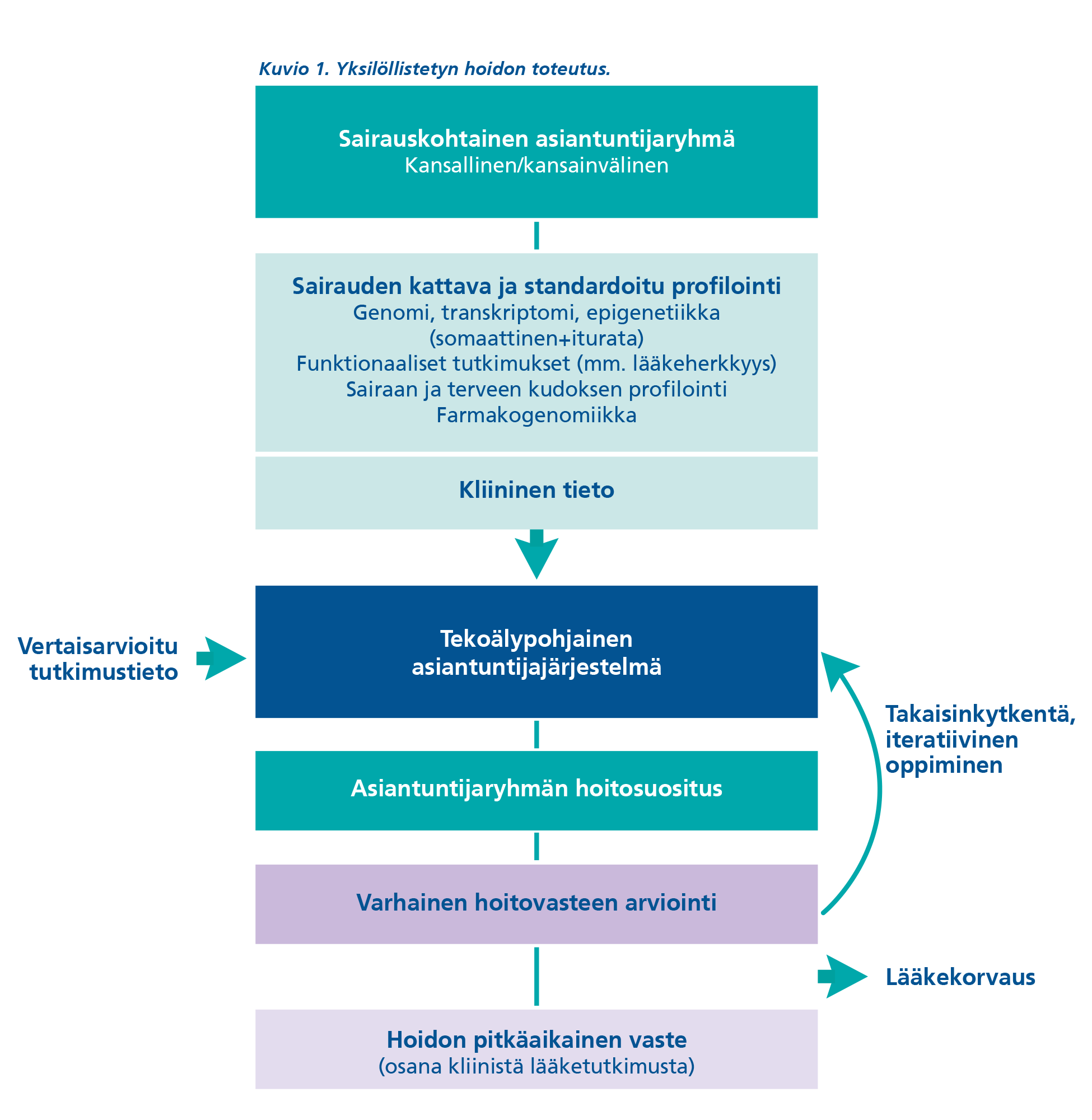
Kuvion 1 tekstivastine saavutettavassa muodossa (pdf).
Jotta yksilöllistetyn lääkehoidon toteutus olisi nykyistä sujuvampaa, tulisi Suomen kaksikanavaista lääkekorvausjärjestelmää uudistaa. Tulisi harkita, mikä on riittävä näyttö lääkkeen korvattavuudelle: Onko asiantuntijaryhmän suositus ja yksittäisen potilaan tarkasti määritelty hoitovaste riittävä perustelu korvattavuudelle? Vai tulisiko kaikki yksilöllistetty hoito toteuttaa kliinisen lääketutkimuksen muodossa?
Kansainvälinen keskustelu varhaisen tutkimusvaiheen (variaatio I) ohittaneiden molekyylien hyödyntämisestä yksilöllistetyssä hoidossa on alkanut, mutta asenteiden muuttaminen vie aikaa. Lisäksi tarvitaan yhteistyötä lääkeyritysten välillä, jotta ei-myyntiluvallisia molekyylejä voidaan käyttää myös yhdistelmähoidossa.
Vaikka tutkijayhteisössä on laaja yksimielisyys siitä, että yksilöllistäminen on avain parempiin hoitotuloksiin, tulee yksilöllistetyn hoidon hyöty osoittaa formaalisissa lääketutkimuksissa.
Yksilöllistetyn hoidon tiellä on vielä mutkia. Silti sen tavoite on selkeä ja ongelmat voitettavissa. Hoito tulee kuitenkin olemaan poikkeuksellisen kallista (usean uuden täsmälääkkeen samanaikainen tai perättäinen käyttö), ja siksi toteutus ei ole mahdollista ilman kattavaa dialogia tutkijoiden, lääkäreiden, potilaiden, lainsäätäjien ja lääkeyritysten välillä.
Kirjallisuutta
Pemovska T, ym. Axitinib effectively inhibits BCR-ABL1 (T315I) with a distinct binding conformation. Nature 2015; 519(7541): 102–5.
Topol E. Deep Medicine: How Artificial Intelligence Can Make Healthcare Human Again. Basic Books. 2019.