Plasmaperäisten lääkevalmisteiden turvallinen käyttö on jatkuvan seurannan kohteena. Luovuttajien veri tutkitaan yhä luotettavimmilla testausmenetelmillä, jolloin veren välityksellä tarttuvat taudit havaitaan aiempaa paremmin. Lisäksi käytössä on määräykset pysyvästä luovutuskiellosta, jos luovuttaja todetaan sopimattomaksi riskiensä takia.
Veren terapeuttinen käyttö sai alkunsa jo 1900-luvun alussa ihmisen kokoveren siirron yleistyessä. Plasmaperäisten lääkevalmisteiden teollinen valmistaminen kehittyi kuitenkin vasta 1940-luvulla, jolloin Edwin J. Cohn työtovereineen kehitti plasman fraktioinnin. Plasmaperäisten lääkkeiden valmistaminen perustuu edelleen edellä mainittuun etanolifraktiointiin.
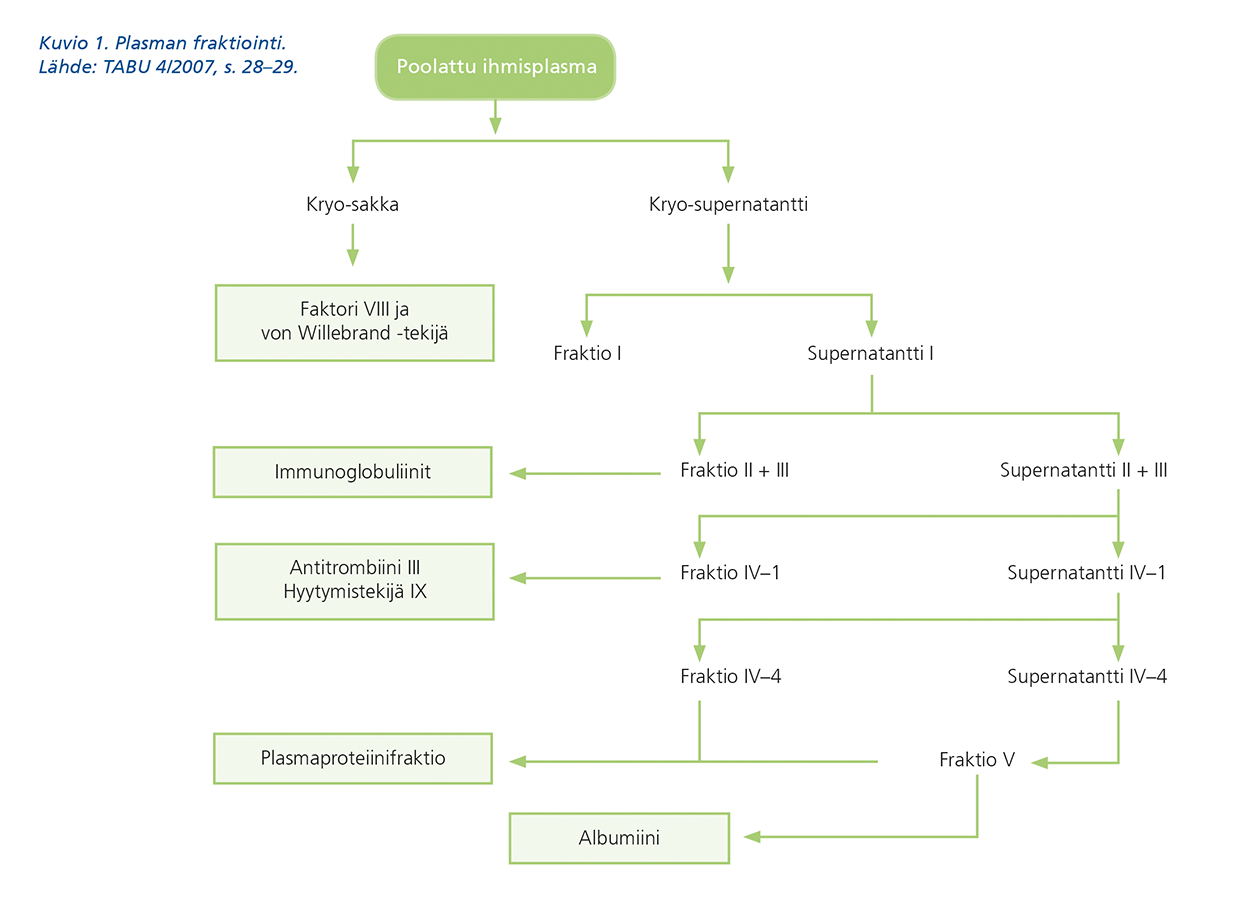
Ihmisverestä otetaan kaikki komponentit talteen (kuvio 1). Proteiinien puhdistaminen ja käytön turvallisuus ovat parantuneet merkittävästi ajan myötä. On huomattava, että verensiirrossa virusturvallisuus on yksilökohtainen, mutta plasmavalmisteita käytettäessä useat potilaat voivat altistua virusinfektiolle. Tämän takia veren virusturvallisuus on erityisen tarkastelun kohteena.
Verenluovuttajien virusinfektioiden seulontaan tarkoitetut testausmenetelmät ovat herkempiä kuin ennen. Serologisten testien, eli vasta-aineiden toteamiseen tarkoitettujen testien, lisäksi viruksia todetaan myös nukleiinihappojen monistamiseen perustuvalla menetelmällä (PCR, NAT), jolloin myös latenssivaiheen infektiot voidaan todeta ennen kuin vasta-aineita on muodostunut. Veren välityksellä tarttuvan variantti Creutzfeldt-Jakobin taudin (vCJD) leviäminen pyritään estämään hylkäämällä sellaiset verenluovuttajat, joiden perheenjäsenillä on todettu vCJD, tai henkilöt, jotka ovat saaneet sarveis- tai kovakalvon siirrännäisen tai joita on aiemmin hoidettu ihmisen aivolisäkkeestä saaduilla lääkkeillä. Lisäksi vuoden kestänyt oleskelu Isossa-Britanniassa vuosina 1980–1996, jolloin CJD-riski oli korkeimmillaan, on esteenä veren luovutukselle.
Valmistusprosesseissa on useita viruksia tuhoavia tai poistavia vaiheita, jotka lisäävät plasmaperäisten valmisteiden virusturvallisuutta. Cohnin etanolifraktiointi tuhoaa osin vaipallisia viruksia. Menetelmää kehitettiin lisäämällä detergenttiliuotinkäsittely (S/D=solvent detergent) tehostamaan vaipallisten virusten tuhoutumista. Matalaa pH:ta ja pepsiinikäsittelyä käytetään myös virusten inaktivoimiseksi. Virussuodatus 15–20 nm:n huokoskoon suodattimella on kaikkein tehokkain virusten poistomenetelmä, koska se poistaa sekä vaipalliset että vaipattomat virukset. Parvovirukset ovat ongelmallisia, sillä ne ovat sekä pieniä ja että fysikaalisesti kestäviä. Euroopan monografiassa onkin asetettu raja näille viruksille, jos plasmaa käytetään anti-D-immunoglobuliinin valmistamiseen.
Plasman sertifiointi
Euroopan parlamentti on asettanut niin sanottuna veridirektiivinä tunnetun direktiivin 2002/98/EC, jonka jäsenmaat ovat hyväksyneet kansallisesti 8. helmikuuta 2005. Tämä direktiivi asettaa velvoitteet ihmisveren luovutuskeskuksille ja testauksille riippumatta siitä, mikä veren käyttötarkoitus on.
Euroopan lääkevirasto (EMA) on myöntänyt Plasma Master File (PMF) -sertifikaatteja vuodesta 2004 plasmaperäisten lääkkeiden laadun ja turvallisuuden lisäämiseksi. Plasman sertifiointi tarkoittaa sitä, että plasman laatu on arvioitu ja hyväksytty keskitetysti. Näin jokainen EU:n jäsenmaa voi hyväksyä sertifioidun plasman lääkevalmistukseen. PMF:ssä ei ole suljettuja osia, vaan kaikki tieto on avoinna saatavilla. Tämä helpottaa sekä lääkearviointia että plasmaperäisten lääkevalmistajien dokumentointia.
PMF-aineiston arvioi kaksi jäsenmaan laatuarvioijaa. Ihmisplasmasta selvitetään sen kaikki vaiheet veren luovutuksesta plasmapooliin. Plasman sertifioinnin ehdottomasti suurin hyöty on plasmaperäisten valmisteiden turvallisuuden parantuminen, koska sertifiointi uusitaan vuosittain. Tällöin PMF:n haltijan tulee toimittaa pakollinen epidemiologinen selvitys, jossa ilmoitetaan ensiluovuttajien ja toistuvasti luovuttavien HI-, hepatiitti-C- ja hepatiitti-B-virusinfektioiden esiintyvyys. Useimmiten PMF:issä ilmoitetaan myös hepatiitti-A- ja parvo-B-viruksen esiintyvyys. Tärkeä osa virusturvallisuutta on luovuttajien jäljitettävyys. Näin myös latentit infektiot voidaan jäljittää ja mahdollisesti infektoituneet valmiste-erät saadaan pois markkinoilta.
EU:n viranomainen tarkistaa sertifioidun PMF:n haltijan verenluovutuskeskukset kahden vuoden välein, ellei riskiperusteisesti voida hyväksyä pidempiä tarkastusvälejä. EU:n tarkastajat tarkastavat myös EU:n ulkopuolisia keskuksia, millä pyritään siihen, että EU:n vaatimat standardit täyttyvät keskuksissa. Jos ilmenee epäilyttäviä verenluovutuskeskuksia virusmarkkereiden suhteen tai poikkeamia laatujärjestelmästä (GMP), niihin päästään puuttumaan aiempaa nopeammin ja voidaan ryhtyä ripeästi korjaaviin toimenpiteisiin. Voidaan sanoa, että plasmatuotteiden turvallisuus on sertifioinnin myötä entistä paremmalla tasolla.
Kirjallisuutta
Plasman sertifiointi: Guideline on the Scientific Requirements for a Plasma Master File (BWP/3794/03)
Plasmaperäisten valmisteiden valmistus: Note for Guidance on Plasma-Derived Products (BWP/269/95)
Saarela S, ym. Biologisten lääkkeiden turvamurheet. Sic! 2012; 2(3).


