Lääkekehitys elää muutosvaihetta. Uudet lääkkeet vaativat uudenlaisia tutkimusasetelmia ja tuovat erityisiä haasteita viranomaisvalvonnalle.

Uusien lääkkeiden kliininen kehitys on tavallisesti jaettu neljään vaiheeseen (kuvio 1A) eli faasiin. Vain harva nykyisin hyväksyttävistä uusista lääkeaineista kuitenkaan noudattaa tätä perinteistä kaavaa. Eri faasit ovat kulkeneet lääkekehityksessä osittain päällekkäin jo pitkään.
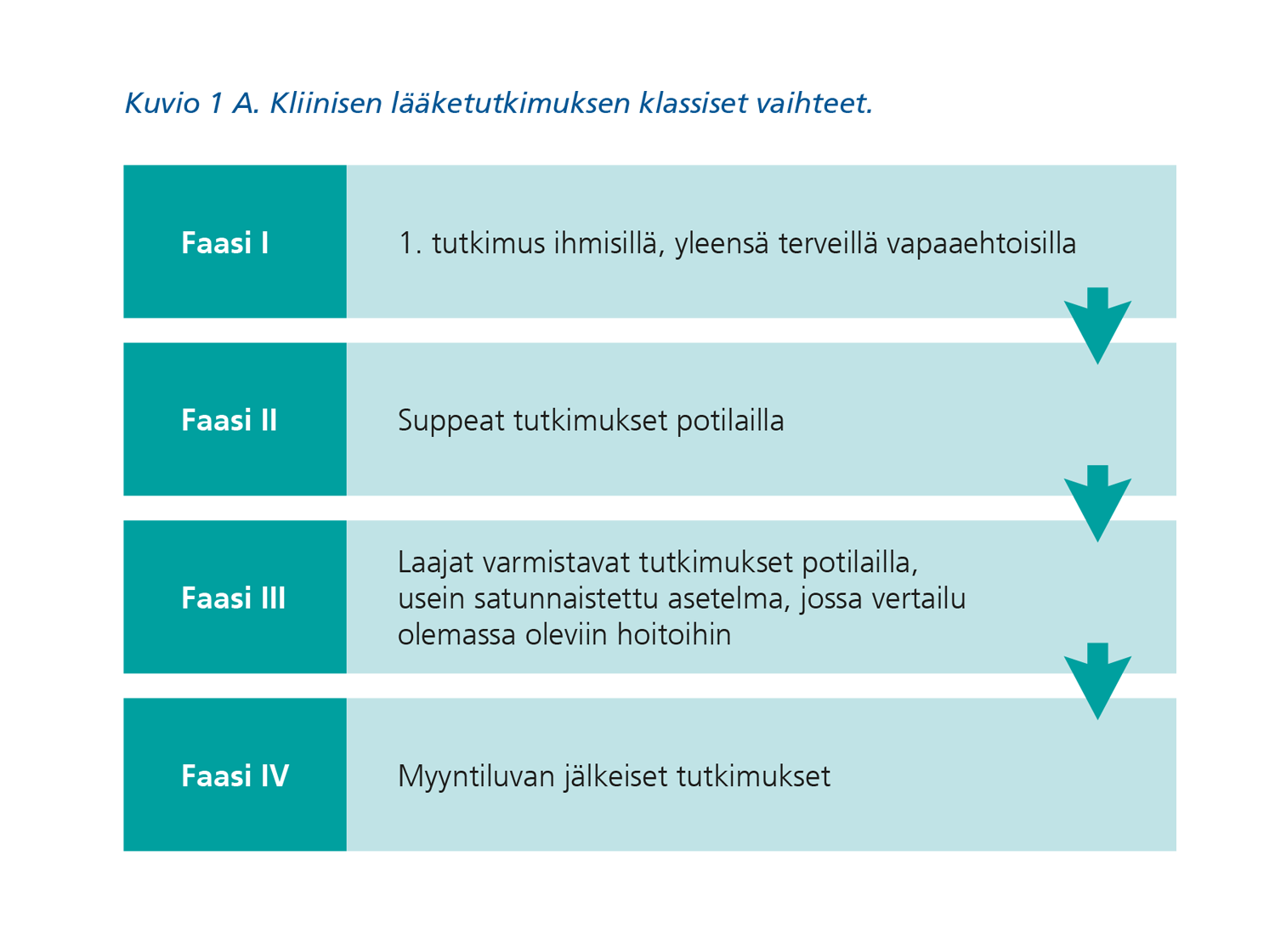
Eri faasien tutkimuksia voidaan yhdistää yhdeksi kokonaisuudeksi, jolloin lääkekehitysvaiheiden kestoa voidaan lyhentää. Puhutaan saumattomista tai integroiduista tutkimuksista (seamless trials), joita ovat esimerkiksi faasin I/II tai faasin II/III tutkimukset. Tällöin protokollassa on määritetty ne ehdot, joiden mukaan edetään seuraavaan vaiheeseen, ja hallinnollisesti kyse on yhdestä tutkimuksesta.
Saumaton tutkimus on yksi esimerkki adaptiivisesta tutkimusasetelmasta, jonka protokollassa määritellään mahdollisuus muuttaa koeasetelman yhtä tai useampaa olennaista seikkaa suunniteltujen välianalyysien avulla. Tällöin tutkimusfaasien välinen ero häviää lähes täysin, ja tutkimuksen kuluessa tehtäviä merkittäviä tutkimussuunnitelmien muutoksia tehdään entistä enemmän yksittäisissä tutkimuksissa. Tämä suuntaus näkyy siinä, että Fimeaan tulee aiempaa enemmän tutkimussuunnitelmien muutosilmoituksia yhtä tutkimusta kohden. Perinteisten neljän vaiheen sijaan lääkekehitys jakautuukin tulevaisuudessa entistä enemmän vain kahteen vaiheeseen: kokeelliseen ja vahvistavaan (kuvio 1B) vaiheeseen.

Kori-, sateenvarjo- ja alustatutkimukset
Adaptiivisia lähestymistapoja hyödyntävät uudet tutkimustyypit kuten kori- ja sateenvarjotutkimukset sekä alusta (platform) -tutkimukset (kuvio 2). Näissä käytetään useimmiten biomarkkereita ohjaamaan hoidon valintaa (Palomäki, ym., tässä numerossa). Uusille koeasetelmille on tyypillistä niin sanotun master protokollan käyttö, jolla tarkoitetaan kaikkiin alaprotokolliin sovellettavia yhteisiä protokollan elementtejä kuten tutkimuksen tarkoitus, päätetapahtumat, hyöty-haittasuhteen arviointi, monitorointi ja turvallisuuden seuranta sekä kriteeristö, jonka perusteella tutkittavat jaetaan sopiviin alaprotokollien mukaisiin tutkimusryhmiin.
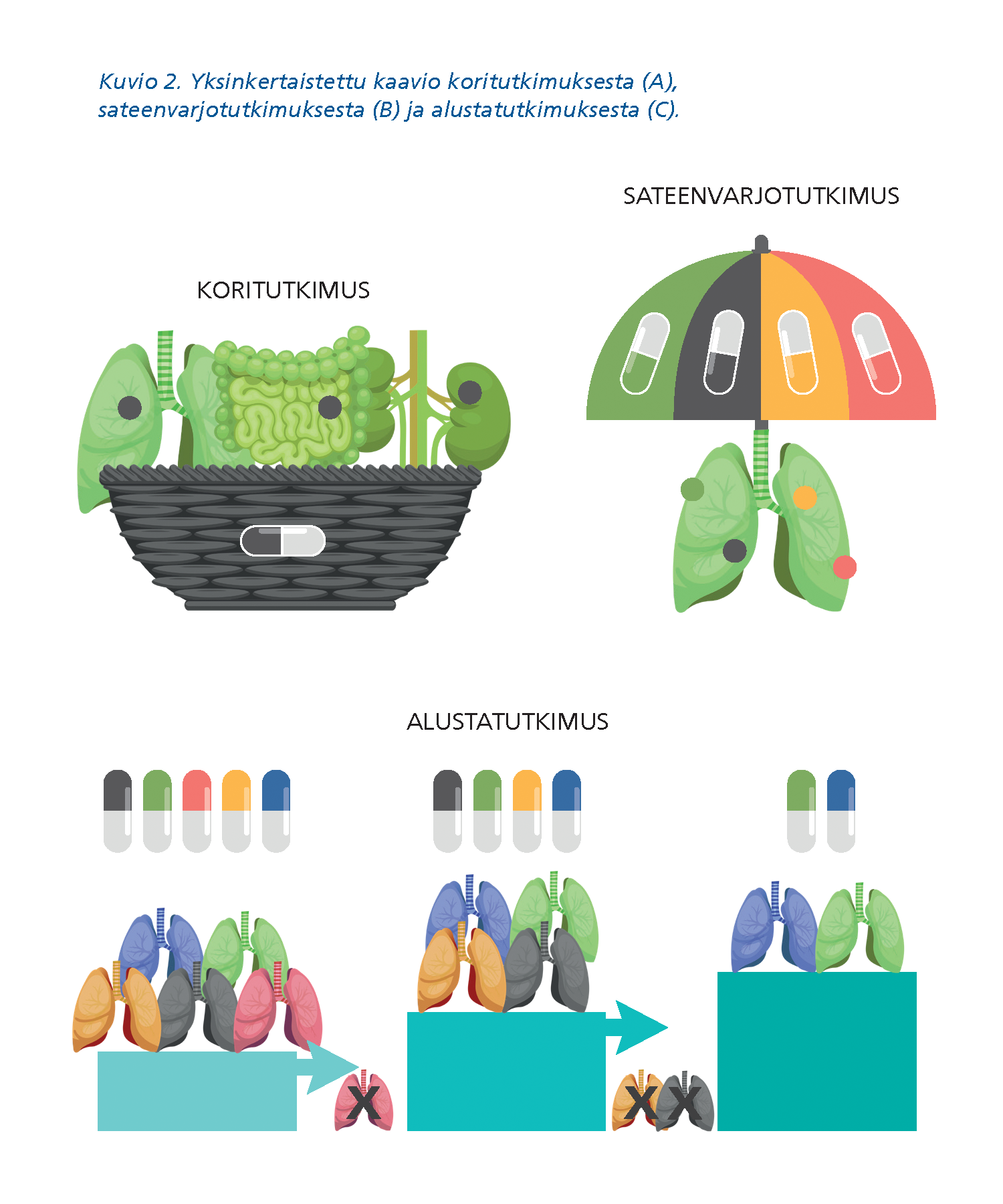
Koritutkimuksessa yhtä tutkimusvalmistetta käytetään eri potilasryhmillä, jolloin hoito kohdistetaan esimerkiksi syövässä esiintyvään molekyylitason muutokseen riippumatta siitä, missä elimessä syöpä sijaitsee. Tyypillinen esimerkki koritutkimuksesta on yksittäiseen geenimutaatioon perustuva lääkehoito, jota sovelletaan useille eri syöpätyypeille, joissa kyseinen geenimutaatio on todettu. Tällöin on periaatteessa mahdollista saada lääkeaineelle myyntilupa samanaikaisesti useaan eri syöpätyyppiin, joissa kyseinen muutos on todettu (ns. kudostyyppi-agnostinen käyttöaihe). Yhdysvalloissa on hiljattain hyväksytty myyntilupa larotrektinibille. Sen käyttöaiheena on parantumaton syöpä, jossa on todettu NTRK-geenifuusio, ei tietty syöpätyyppi (Palomäki, ym., tässä numerossa). Myös Euroopan alueella ensimmäiset vastaavat myyntiluvat on myönnetty – joskin ehdollisena.
Sateenvarjotutkimuksessa kudostyypiltään samaa syöpätyyppiä sairastavat potilaat jaetaan kasvaimessa todettujen molekyylitason muutosten (biomarkkereiden) perusteella eri alaryhmiin, jolloin kukin alaryhmä saa biomarkkerin perusteella kohdennettua, yksilöllistettyä lääkehoitoa.
Alustatutkimuksessa samaa sairautta hoidetaan yhdessä tutkimuksessa samanaikaisesti useilla eri lääkevalmisteilla, jolloin potilaiden jako eri lääkevalmistekohortteihin perustuu biomarkkeritutkimuksiin (kuvio 2).
Tällöin eri kohortteja voidaan verrata vakiintuneeseen hoitoon, joka toimii yhteisenä verrokkikohorttina. Alustatutkimuksessa on mahdollista ennalta suunniteltujen välianalyysien perusteella muokata tutkimusta sen edetessä, esimerkiksi lopettaa kohortteja ja/tai lisätä uusia kohortteja uusien lääkevalmisteiden tullessa saataville. Tällöin eri tutkimuskohortit ovat käynnissä limittäin ja saattavat päättyä eri aikoihin. Master protokolla määrittelee koko tutkimuksen raamit.
Alustatutkimuksessa potilaat jaetaan biomarkkeritestin perusteella positiivisiin ja negatiivisiin ryhmiin, jotka satunnaistetaan saamaan biomarkkeriin pohjautuvia lääkehoitoja tai vakiohoitoa. Tutkimuksen kuluessa on tehty ennalta suunniteltuja välianalyyseja, joiden perusteella osassa kohorteista hoito on osoittautunut määrätyin kriteerein tehottomaksi verrattuna vakiohoitoon (kuvio 2, rastitetut kohortit). Uuden biomarkkerin ja siihen kohdennetun lääkkeen tullessa saataville on tutkimukseen mahdollista avata jälleen uusi kohortti (ei esitetty kuviossa 2).
Adaptiivisissa tutkimuksissa biomarkkeridiagnostiikan rooli on keskeinen. Tällöin puhutaan lääkehoidon ja diagnostiikan yhdistävistä lääkinnällisistä laitteista (companion diagnostics). Tällä tarkoitetaan in vitro -diagnostista testiä, jonka tekeminen on edellytyksenä lääkeaineen tehokkaalle ja turvalliselle käytölle. EU-asetuksen 2017/746 mukaan lääkehoidon ja diagnostiikan yhdistävät laitteet ovat olennaisia arvioitaessa potilaan soveltuvuutta tiettyyn lääkehoitoon, koska määrittämällä määrällisesti tai laadullisesti tietyt merkkiaineet voidaan tunnistaa henkilöt, joilla on suurempi riski kehittää haitallinen reaktio kyseiseen lääkkeeseen, tai potilaat, joiden osalta terapeuttista tuotetta on tutkittu asianmukaisesti ja se on todettu turvalliseksi ja tehokkaaksi.
Adaptiiviset koeasetelmat voivat olla haastavia tulkita
Adaptiiviset koeasetelmat asettavat viranomaisvalvonnalle erityisiä haasteita. Yhdysvaltain elintarvike- ja lääkevirasto (FDA) ja Euroopan lääkevirastojen kliinisten tutkimusten edistämistyöryhmä (Clinical trials facilitation and coordination group) ovat julkaisseet omat ohjeistuksensa adaptiivisista tutkimuksista. Adaptiivisissa tutkimuksissa voidaan tehdä tutkimuksen kuluessa merkittäviä muutoksia, jotka voivat koskea otoskokoa, lääkeannosta, asetelmaa (esim. satunnaistamissuhdetta), jopa päätetapahtumaa. Tällöin alkuperäinen tutkimusasetelma voi hämärtyä, mikä vaikeuttaa tulosten tulkintaa ja johtopäätösten tekemistä. Adaptiiviset tutkimukset vaativat huolellista tilastollista ja menetelmällistä suunnittelua ja koordinaatiota. Eri viranomaiset ovat korostaneet adaptiivisten lääketutkimusten vaativan täyttä tyypin I virheen kontrollointia, ja tutkimuksen validiteetin ja integriteetin säilymisen tärkeyttä.
Lue lisää lääkeviranomaisten ohjeistuksista
FDA. Adaptive designs for clinical trials of drugs and biologics guidance for industry, draft guidance. www.fda.gov
HMA/Clinical trials facilitation and coordination group. Recommendation paper on the initiation and conduct of complex clinical trials. www.hma.eu
Kirjallisuutta
Alanne E, ym. Geenidiagnostiikkaan perustuva syövän hoito – tätä päivää, tulevaisuutta vai toiveajattelua? Duodecim 2018; 134(2): 126–32.
Tenhunen O, ym. Kliinisen lääketutkimuksen uudet tutkimusasetelmat. Duodecim 2017; 133(6): 599–605.


